

 、④-
、④- 、⑨-
、⑨- ),則該化合物的化學式為:MgCNi3(用元素符號表示).
),則該化合物的化學式為:MgCNi3(用元素符號表示).
分析 由元素周期表可以得出元素①為H,②為C,③為O,④為Mg,⑤為Mn,⑥為Fe,⑦為Cl,⑧為Ca,⑨為Ni,⑩為Cu;
(1)依據元素所在周期和族回答;元素⑤是Mn,其3d軌道為半充滿,4s軌道全充滿,據此解答即可;
(2)s區為元素周期表的前2列;
(3)晶體的晶胞結構可以確定各個原子的個數;
(4)形成配離子具備的條件為:中心原子具有空軌道,配體具有孤對電子對;根據價層電子對互斥理論確定雜化方式;
(5)某元素的特征電子排布式為nsnnpn+1,則n=2,故該元素的特征電子排布式為2s22p3,為N原子,元素①為H元素,與X形成的物質為NH3,為三角錐型,①與③形成的分子為H2O,NH3與H2O都是極性分子,且分子之間能形成氫鍵;
(6)價層電子對互斥理論認為:分子的立體構型是“價層電子對”相互排斥的結果.價層電子對就是指分子中的中心原子上的電子對,包括σ 鍵電子對和中心原子上的孤電子對;σ 鍵電子對數和中心原子上的孤電子對數之和就是價層電子對數,由于價層電子對的相互排斥,就可得到含有孤電子對的VSEPR模型,略去孤電子對就是該分子的空間構型.
解答 解:(1)元素⑩為Cu,處于元素周期表中第四周期第IB族,⑤為Mn元素,3d軌道為半滿狀態,4s軌道全充滿,其電子排布式為:1s22s22p63s23p63d54s2,價電子排布為:3d54s2,故答案為:第四周期第IB族,3d54s2;
(2)屬于s區的元素是①④⑧,故答案為:①④⑧;
(3)根據晶體的晶胞結構,每個晶胞含有一個Mg,含有Ni個數為:6×$\frac{1}{2}$=3,含有C個數為:8×$\frac{1}{8}$=1,故該晶體的化學式為:MgCNi3,故答案為:MgCNi3;
(4)形成配離子具備的條件為:中心原子具有空軌道,配體具有孤對電子對,CN-中C原子與N原子鍵以三鍵連接,三鍵中有1個δ鍵、2個π鍵,C原子還有一對孤對電子,雜化軌道數2,C原子采取sp雜化,故答案為:具有孤對電子;sp;
(5)某元素的特征電子排布式為nsnnpn+1,則n=2,故該元素的特征電子排布式為2s22p3,該原子外層電子數為5,①與③形成的分子為H2O,NH3與H2O都是極性分子,且分子之間能形成氫鍵,故NH3在H2O中的溶解度很大,故答案為:NH3與H2O都是極性分子,根據相似相溶原理,極性分子易溶于極性溶劑中,且分子之間能形成氫鍵;
(6)NH3分子的中心原子N原子上含有3個σ 鍵,中心原子上的孤電子對數=$\frac{1}{2}$(5-3×1)=1,所以NH3的VSEPR模型是四面體型,略去孤電子對后,其空間構型是三角錐形;故答案為:因NH3中N原子有孤電子對,所以NH3為三角錐形.
點評 本題是一道結構化學知識的題目,考查了學生有關原子結構和晶體結構的知識,綜合性強,難度大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
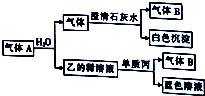 將一黑色固體單質甲投入乙的濃溶液中共熱,劇烈反應產生混合氣體A,A存在如圖轉化關系,試回答下列問題:
將一黑色固體單質甲投入乙的濃溶液中共熱,劇烈反應產生混合氣體A,A存在如圖轉化關系,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
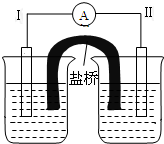 根據反應Fe+Fe2(SO4)3=3FeSO4設計的雙液原電池如圖所示.
根據反應Fe+Fe2(SO4)3=3FeSO4設計的雙液原電池如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ba(OH)2溶液中加入過量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加入少量Na2S溶液:2Fe3++S2-═2Fe2++S↓ | |
| C. | 將適量CO2通入NaClO溶液中(已知次氯酸的K1為2.95×10-8)ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Ca(OH)2溶液中加入過量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解精煉銅時,粗銅作陰極 | |
| B. | 電解精煉銅時,溶液濃度基本不變 | |
| C. | 在鐵制容器上鍍銅時,可用CuSO4溶液作電鍍液 | |
| D. | 在鐵制容器上鍍銅時,鐵制容器連接外接電源的正極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在密閉容器中發生反應N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示.下列說法正確的是( )
在密閉容器中發生反應N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示.下列說法正確的是( )| A. | 反應溫度:T1>T2 | B. | a、b兩點的平衡常數:Kb>Ka | ||
| C. | a、c兩點氣體的顏色:a淺,c深 | D. | b、c兩點的反應速率:v(b)>v(c) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | 不純物質 | 除雜試劑 | 分離方法 |
| ① | 苯(苯酚) | ||
| ② | 酒精(水) | ||
| ③ | 溴苯(Br2) | ||
| ④ | 乙烯(SO2) | ||
| ⑤ | 乙酸乙酯(乙酸) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com