
| A | NaCl═Na++Cl-; NH3•H2O?NH4++OH- | 均屬于電離方程式 |
| B | Ba2++SO42-═BaSO4↓; HCO3-+OH-═CO32-+H2O | 均可表示一類反應 |
| C | 向溶液中滴加鹽酸酸化過的BaCl2溶液,出現白色沉淀 | 說明該溶液中一定有SO42- |
| D | Cl2+2NaOH═NaCl+NaClO+H2O; 3S+6NaOH═2Na2S+Na2SO3+3H2O | Cl2和S在反應中既作氧化劑又作還原劑 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化鈉電離生成鈉離子、氯離子;一水合氨電離生成氨根離子和氫氧根離子;
B.依據離子方程式的意義解答;
C.生成的白色沉淀可能為氯化銀,原溶液中不一定含有硫酸根離子;
D.依據Cl2和S在反應中化合價變化解答.
解答 解:A.氯化鈉電離生成鈉離子、氯離子,電離方程式為:NaCl=Na++Cl-;一水合氨電離生成氨根離子和氫氧根離子,電離方程式為:NH3•H2O?NH4++OH-,故A正確;
B.Ba2++SO42-=BaSO4↓可以表示可溶性鋇鹽與可溶性硫酸鹽反應生成硫酸鋇沉淀的反應;HCO3-+OH-=CO32-+H2O表示可溶性碳酸氫鹽與可溶性強堿反應生成可溶性碳酸鹽和水,故B正確;
C.向溶液中滴加鹽酸酸化過的BaCl2溶液,出現白色沉淀,該白色沉淀可能為氯化銀,原溶液中可能含有銀離子,不一定含有硫酸根離子,故C錯誤;
D.Cl2+2NaOH=NaClO+H2O,反應中氯元素化合價既升高有降低,氯氣既作氧化劑又作還原劑,3S+6NaOH=2Na2S+Na2SO3+3H2O,反應中硫元素化合價既升高有降低,硫既作氧化劑又作還原劑,故D正確;
故選C.
點評 本題考查了離子方程式的書寫、離子方程式表示的意義及離子的檢驗方法,題目難度中等,明確離子的性質、離子方程式書寫的方法是解題關鍵,試題培養了學生的靈活應用能力.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題

| A. | 制取玻璃和粗硅的同時均產生CO2氣體 | |
| B. | 生產高純硅、鋁、銅及玻璃的過程中都涉及氧化還原反應 | |
| C. | 粗硅制高純硅時,提純四氯化硅可用多次蒸餾的方法 | |
| D. | 黃銅礦冶煉銅時產生的SO2可用于生產硫酸,FeO可用作冶煉鐵的原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮、磷、砷是同族元素,該族元素單質及其化合物在農藥、化肥等方面有重要應用.請回答下列問題.
氮、磷、砷是同族元素,該族元素單質及其化合物在農藥、化肥等方面有重要應用.請回答下列問題.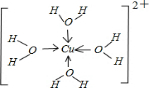 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 標準狀況下,1L庚烷完全燃燒所生成的氣態產物的分子數為$\frac{7}{224}$NA | |
| B. | 1mol甲基(-CH3)所含的電子總數為10NA | |
| C. | 0.5摩1,3-丁二烯分子中含有C=C雙鍵數為NA | |
| D. | 28g乙烯所含共用電子對數目為6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com