
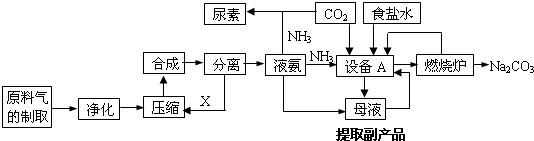
分析 (1)利用蓋斯定律,抵消中間產物,得到目的反應,計算△H;平衡常數是利用生成物平衡濃度冪次方乘積除以反應物平衡濃度冪次方乘積得到;方程式相加時,總平衡常數等于分方程的平衡常數之積;
(2)反應到達平衡狀態時,正逆反應速率相等(同種物質)或正逆反應速率之比等于系數之比(不同物質),平衡時各種物質的物質的量、濃度等不再發生變化;
(3)根據電荷守恒,判斷離子濃度大小;氨水的電離平衡常數為電離出離子的濃度積與溶質濃度的比值;
(4)NH3不能與電解質反應及正極得到電子化合價升高.
解答 解:(1)利用蓋斯定律,反應①×2+反應②+反應③,得到目的反應,△H=-91kJ•mol-1
+(-24kJ•mol-1)+(-41kJ•mol-1)=-247kJ•mol-1,
反應①×2+反應②+反應③相加得總方程,則總方程的平衡常數等于分方程的平衡常數之積,即K=K12•K2•K3,
故答案為:-247kJ•mol-1; K=K12•K2•K3;
(2)a、反應前后氣體體積不同,當壓強一定時,達到化學平衡狀態,故a正確;
b、體系體積一定,反應前后氣體質量相同,密度始終不變,不能判斷是否平衡,故b錯誤;
c、CO和H2的物質的量保持不變,則其他各物質濃度亦保持不變,達到化學平衡狀態,故c正確;
d、CO的消耗速率等于CO2的生成速率,均為正反應方向,不能判斷是否平衡,故d錯誤;
故選ac;
(3)寫出電荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液呈中性,即c(H+)=c(OH-),即c(NH4+)=c(Cl-);氨水中的電離常數為$\frac{c(N{{H}_{4}}^{+}).c({H}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{y.1{0}^{-7}}{x-y}$=$\frac{1{0}^{-7}y}{x-y}$,故答案為:=;
$\frac{1{0}^{-7}y}{x-y}$;
(4)因NH3能與水反應,所以溶液呈堿性,因正極得到電子化合價升高,所以電極反應為:O2+2H2O+4e-=4OH-,故答案為:堿性;O2+2H2O+4e-=4OH-.
點評 本題考查弱電解質的電離、電化學原理、蓋斯定律等知識點,側重考查學生運用化學原理解答問題能力,易錯點是化學平衡狀態判斷,只有反應前后改變的物理量才能作為化學平衡狀態判斷依據.


 互動英語系列答案
互動英語系列答案科目:高中化學 來源: 題型:選擇題
| A. | 將pH=4的鹽酸和醋酸稀釋成pH=5的溶液,醋酸所需加入的pH變大 | |
| B. | 鹽酸和醋酸都可用相應的鈉鹽與濃度硫酸反應制取 | |
| C. | 相同pH的鹽酸和醋酸溶液中分別加入相應的鈉鹽固體,醋酸的pH變大 | |
| D. | 相同pH的鹽酸和醋酸分別跟鋅反應時,產生氫氣的起始速率相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
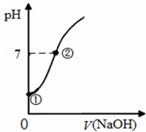 常溫下,向飽和氯水中逐滴滴入0.1mol/L的氫氧化鈉溶液,pH變化如圖所示,下列有關敘述正確的是( )
常溫下,向飽和氯水中逐滴滴入0.1mol/L的氫氧化鈉溶液,pH變化如圖所示,下列有關敘述正確的是( )| A. | ①點所示溶液中只存在次氯酸的電離平衡 | |
| B. | ②點所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的電離程度逐漸減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Na<Mg<Al | B. | 熱穩定性:HCl>H2S>PH3 | ||
| C. | 酸性強弱:H2SiO4<H2CO3<H2SO4 | D. | 熱穩定性H2O>H2Se>H2S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ①②③④ | C. | ①③④⑤ | D. | 只有② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | 原子半徑/nm | 主要化合價 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
| A. | Z的氫化物的穩定性強于L的氫化物的穩定性 | |
| B. | Y與Q形成的化合物不能跟氫氧化鈉溶液反應 | |
| C. | 等物質的量的X、Y的單質與足量的鹽酸反應,生成的H2一樣多 | |
| D. | 在化學反應中,M原子與其他原子易形成共價鍵而不易形成離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
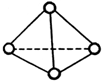 科學家已獲得了極具理論研究意義的N4分子,其結構為正四面體(如圖),與白磷分子相似.已知斷裂1molN-N鍵吸收192kJ熱量,斷裂1molN≡N鍵吸收946kJ熱量,則( )
科學家已獲得了極具理論研究意義的N4分子,其結構為正四面體(如圖),與白磷分子相似.已知斷裂1molN-N鍵吸收192kJ熱量,斷裂1molN≡N鍵吸收946kJ熱量,則( )| A. | 1molN4氣體轉化為N2時要吸收206kJ能量 | |
| B. | N4是一種新型化合物 | |
| C. | 1molN4氣體轉化為N2時要放出740kJ能量 | |
| D. | N4是N2的同位素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com