
| A. | 氫鍵是一種特殊化學鍵,它廣泛地存在于自然界中 | |
| B. | 在 分子中含有1個手性C原子 分子中含有1個手性C原子 | |
| C. | 碘單質(zhì)在水溶液中溶解度很小是因為I2和H2O都是非極性分子 | |
| D. | 含氧酸可用通式XOm(OH)n來表示,若n值越大,則含氧酸的酸性越強 |
分析 A、氫鍵是一種分子間作用力,不是化學鍵;
B、一個碳原子與其它四個不同的原子或原子團相連的碳為手性C原子;
C、I2和是非極性分子而H2O是極性分子,非極性分子難溶于極性溶劑;
D、含氧酸可用通式XOm(OH)n來表示,式中m大于等于2的是強酸,m為0的是弱酸,據(jù)此可知,非羥基氧原子數(shù)目越大,酸性越強.
解答 解:A、氫鍵是一種分子間作用力,不是化學鍵,故A錯誤;
B、一個碳原子與其它四個不同的原子或原子團相連的碳為手性C原子,中間的碳為手性C原子,故B正確;
C、I2和是非極性分子而H2O是極性分子,非極性分子難溶于極性溶劑,相似相溶的所以碘單質(zhì)在水溶液中溶解度很小,故C錯誤;
D、含氧酸可用通式XOm(OH)n來表示,式中m大于等于2的是強酸,m為0的是弱酸,據(jù)此可知,非羥基氧原子數(shù)目越大,酸性越強,故D錯誤;
故選B.
點評 本題考查分子間作用力和分子的極性、手性C原子,根據(jù)非羥基氧原子數(shù)目多少來確定酸性強弱即可,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 改變平衡混合物的組成 | B. | 提高反應物的平衡轉(zhuǎn)化率 | ||
| C. | 以同樣程度改變正逆反應速率 | D. | 增大正反應速率,降低逆反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
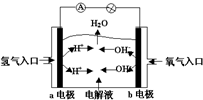
| A. | a電極是負極,電極反應為:H2-2e-═2H+ | |
| B. | b電極是正極,電極反應為:4OH-+4e-═2H2O+O2↑ | |
| C. | 電子從a極流向電流表、小燈泡、b極、通過電解質(zhì)溶液形成閉合回路 | |
| D. | 電解質(zhì)溶液中OH-向a極移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子鍵只有飽和性沒有方向性 | B. | 離子晶體中只含有離子鍵 | ||
| C. | 離子鍵的強弱可用晶格能來衡量 | D. | 離子鍵的強弱可用原子化熱來衡量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S2-+2H2O?H2S+2OH- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在電解池中陰離子向陽極移動;在原電池中陰離子向正極移動 | |
| B. | 在電解池中,陽極發(fā)生氧化反應,在原電池中,負極發(fā)生氧化反應 | |
| C. | 電解池的陽極與電源的正極相連 | |
| D. | 電解過程中,電子從電源的負極流出到達陰極,從陽極流出回到電源的正極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熔融燒堿時,不能使用普通石英坩堝:SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+H2O | |
| B. | 向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+C12═2 Cl-+I2 | |
| C. | 紅熱的鐵絲與水接觸,表面形成藍黑色(或黑色)保護層:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“潔廁靈”(主要成分HCl)混合使用放出氯氣:ClO-+Cl-+2H+═Cl2↑+H2O |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com