

| Ca2+ | Mg2+ | Fe3+ | |
| 開始沉淀時的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀時的pH | 13.9 | 11.1 | 3.2 |
分析 制備BaCl2•2H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質),加鹽酸溶解,碳酸鋇和鹽酸反應:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,調pH為8,Fe3+完全沉淀時的pH為3.2,只有Fe3+完全沉淀,濾渣1為Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氫氧化鈉調節PH=12.5,Ca2+完全沉淀時的pH為13.9,Mg2+完全沉淀時的pH為11.1,Mg2+完全沉淀,Ca2+部分沉淀,濾渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸發濃縮冷卻結晶得到BaCl2•2H2O,
(1)研磨將塊狀固體變成粉末狀,可以增大反應物的接觸面積,增大反應速率;BaCl2溶液為強酸強堿溶液.
(2)根據流程圖和表中數據分析加入NH3•H2O調節pH=8可除去Fe3+,加入NaOH調pH=12.5,可完全除去Mg2+,除去部分Ca2+,濾渣Ⅱ中含Mg(OH)2、Ca(OH)2;加入過量H2C2O4,易發生Ba2++H2C2O4═BaC2O4↓+2H+,產品的產量減少;
(3)利用簡潔酸堿滴定法可測定Ba2+的含量,實驗分兩步進行,根據Ba2++CrO42-═BaCrO4↓、2CrO42-+2H+═Cr2O72-+H20,與Ba2+反應的CrO42-的物質的量為總鹽酸的物質的量減去過量的鹽酸,利用BaCl2溶液的濃度計算公式.
解答 解:制備BaCl2•2H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質),加鹽酸溶解,碳酸鋇和鹽酸反應:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,調pH為8,Fe3+完全沉淀時的pH為3.2,只有Fe3+完全沉淀,濾渣1為Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氫氧化鈉調節PH=12.5,Ca2+完全沉淀時的pH為13.9,Mg2+完全沉淀時的pH為11.1,Mg2+完全沉淀,Ca2+部分沉淀,濾渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸發濃縮冷卻結晶得到BaCl2•2H2O,
(1)化學反應的速率與反應物的接觸面積有關,毒重石用鹽酸浸取前需充分研磨,可以增大反應物的接觸面積,增大反應速率;BaCl2溶液為強酸強堿溶液,可以加熱制取晶體.故答案為:增大接觸面積從而使反應速率加快;能;
(2)根據流程圖和表中數據可知:Fe3+完全沉淀時的pH為3.2,加入氨水,調pH為8,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,濾渣1為Fe(OH)3,加入氫氧化鈉調節PH=12.5,Ca2+完全沉淀時的pH為13.9,Mg2+完全沉淀時的pH為11.1,Mg2+完全沉淀,Ca2+部分沉淀,濾渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4時應避免過量,防止CaC2O4沉淀完全后,過量的H2C2O4會導致生成BaC2O4沉淀,產品的產量減少,
故答案為:Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4過量會導致生成BaC2O4沉淀,產品的產量減少;
(3)步驟Ⅱ:待Ba2+完全沉淀后,再加入酸堿指示劑,用b mol•L-1鹽酸標準液滴定至終點,測得滴加鹽酸的體積為V1mL,則發生2CrO42-+2H+═Cr2O72-+H20 的鹽酸的物質的量為:V1×10-3×bmol,步驟Ⅰ:用b mol•L-1鹽酸標準液滴定至終點,測得滴加鹽酸體積為V0mL,加入的總鹽酸的物質的量:V0×10-3×bmol,Ba2++CrO42-═BaCrO4↓,與Ba2+反應的CrO42-的物質的量為V0×10-3×bmol-V1×10-3×bmol=(V0-V1)b×10-3mol,步驟Ⅱ:移取y mLBaCl2溶液于錐形瓶中,所以BaCl2溶液的濃度為:$\frac{({V}_{0}-{V}_{1})b×1{0}^{-3}}{y×1{0}^{-3}}$mol/L=$\frac{({V}_{0}-{V}_{1})b}{y}$mol/L.故答案為:$\frac{b(V0-V1)}{y}$.
點評 本題考查了實驗室利用毒重石制備BaCl2•2H2O的設計方法,側重考查影響反應速率的因素、實驗基本操作、沉淀溶解平衡的應用等知識,實驗步驟結合物質的性質分析是解答的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:鈉>硫>氯 | |
| B. | 最高價氧化物對應的水化物的酸性:H3PO4<H2SO4<HClO4 | |
| C. | 最高正化合價:氯>硫>磷 | |
| D. | 熱穩定性:碘化氫>溴化氫>氯化氫 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
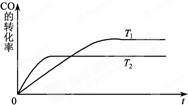 甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用如下反應來合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析該反應并回答下列問題:
甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用如下反應來合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析該反應并回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
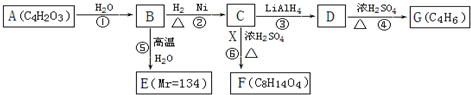
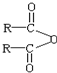 $\stackrel{H_{2}O}{→}$2RCOOH,RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH,RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH ,1molA和足量的H2反應最多消耗掉H2的物質的量為1mol.
,1molA和足量的H2反應最多消耗掉H2的物質的量為1mol.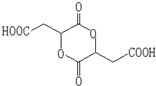 .
.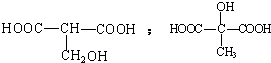 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=+763.3kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-763.3kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-675.3kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-1526.6kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com