
| A. | 稀鹽酸溶液,NaAlO2溶液 | B. | 濃氨水,AgNO3溶液 | ||
| C. | NaOH溶液,AlCl3溶液 | D. | Cu,FeCl3溶液 |
分析 A、稀鹽酸不足生成氫氧化鋁,稀鹽酸過量生成氯化鋁;
B、從氫氧化銀能容于過量的氨水分析;
C、氫氧化鈉過量生成偏鋁酸鈉,氯化鋁過量生成氫氧化鋁沉淀;
D、發生的是氧化還原反應,過量的物質不能繼續反應.
解答 解;A、稀鹽酸溶液加入NaAlO2溶液發生的反應NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,量不同,生成產物不同,故A不符合;
B、濃氨水加入AgNO3溶液發生反應NH3•H2O+AgNO3=AgOH↓+NH4NO3,AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O,量不同,生成產物不同,故B不符合;
C、氫氧化鈉過量生成偏鋁酸鈉,氯化鋁過量生成氫氧化鋁沉淀,不能用同一個化學方程式表示,故C不符合;
D、Cu加入FeCl3溶液只發生反應Cu+2FeCl3=2FeCl2+CuCl2,銅過量不再反應,故D符合;
故選D.
點評 本題考查了物質反應隨量的不同產物不同,同時考查了偏鋁酸鈉、氫氧化鋁、氫氧化銀、氯化鐵等物質的性質.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
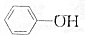 ,③
,③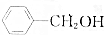 ,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根據官能團的不同可分為( )
,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根據官能團的不同可分為( )| A. | 3類 | B. | 4類 | C. | 5類 | D. | 6類 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=4的硫酸溶液中c(H+):c(SO42-)等于2:1,稀釋10000倍后二者的比值幾乎不變 | |
| B. | 由水電離的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L鹽酸溶液的pH=3,則1.0×10-8mol/L鹽酸溶液的pH=8 | |
| D. | 某溫度下水的離子積為1.0×10-12,等體積的pH=1的H2SO4溶液與pH=11的NaOH溶液混合后溶液呈中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液顏色保持不變,說明上述可逆反應達到平衡狀態 | |
| B. | 若用綠礬(FeS04•7H2O)作還原劑,處理1 L廢水,至少需要458.7g | |
| C. | 常溫下轉化反應的平衡常數K=1×1014,則轉化后所得溶液的pH=6 | |
| D. | 2V正(CrO42-)=V逆(Cr2O72-)時,反應處于平衡態 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素A、B組成的化合物常溫下一定呈氣態 | |
| B. | 元素C、D、E的最高價氧化物對應的水化物兩兩之間能發生反應 | |
| C. | 工業上常用電解C、D的鹽溶液來制備C、D元素的單質 | |
| D. | 化合物AE與CE有相同類型的化學鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | B的氫化物和E的氫化物能反應,且得到的產物只含有共價鍵 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 五種原子中E的原子半徑最大 | |
| D. | A的最低價氫化物的沸點>B的最低價氫化物的沸點 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 | B. | 還原性(堿性溶液):I2>Fe(OH)2>KIO3 | ||
| C. | 熱穩定性:NaCl>NaClO4>NaClO | D. | 酸性(水溶液):HSCN>H2CO3>HCN |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com