
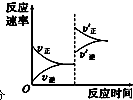
| V2O |
| △ |

| △c |
| △t |
| 0.16mol/L |
| 5min |
| c2(SO3) |
| c2(SO2)c(O2) |
| (0.16)2 |
| (0.04)2×0.02 |
 ;故答案為:
;故答案為: ;
;+ 2 |
+ 2 |


科目:高中化學 來源: 題型:
| A、K+、Ba2+、Cl-、NO3- |
| B、K+、Na+、Br-、S2- |
| C、H+、Fe3+、I-、NO3- |
| D、Na+、Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:
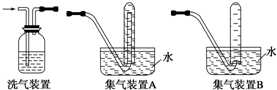
查看答案和解析>>
科目:高中化學 來源: 題型:
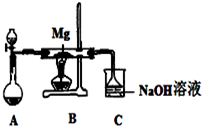 SiO2、SO2和CO2都是酸性氧化物,它們的化學性質有一定的相似性;Mg和Na的化學性質也有一定相似性.某興趣小組用如圖所示裝置進行Mg與SO2反應的實驗.
SiO2、SO2和CO2都是酸性氧化物,它們的化學性質有一定的相似性;Mg和Na的化學性質也有一定相似性.某興趣小組用如圖所示裝置進行Mg與SO2反應的實驗.
| ||
| ||
| 序號 | 實驗步驟 | 預期現象和結論 |
| ① | 取少量反應后的固體于試管I中 | / |
② | 向試管I中的固體慢慢滴加 試管I口塞上帶導管的單孔塞,并將導管通入盛有 | 若試管I中的 則丙同學推測正確.若試管I中的固體未完全溶解,且 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| A、HA的酸性比HB的強,則等濃度的NaA溶液 pH比NaB溶液的小 |
| B、A+和B-的電子層結構相同,則A原子的核電荷數比B原子的小 |
| C、A鹽的溶解度在同溫下比B鹽的大,則A鹽溶液的物質的量濃度比B鹽溶液的大 |
| D、A原子失去的電子比B原子的多,則A單質的還原性比B單質的強 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com