
分析 (1)一定溫度下,將3molA氣體和1molB氣體通入一密閉容器中,若容器體積固定為 2L,反應1min時測得剩余1.8molA,C的濃度為0.4mol/L,則:
3A(g)+B(g)?x C(g)
起始量(mol):3 1 0
變化量(mol):1.2 0.4 0.4x
1min時(mol):1.8 0.6 0.4x
①結合C的濃度計算x;
②后1min內速率小于前1min內反應速率,故后1min內C的濃度變化量小于0.4mol/L;
③令平衡時轉化的B為ymol,表示出平衡時各組分的物質的量,再根據C的體積分數為22%列方程計算解答;
④改變起始物質加入的量,欲使反應達到平衡時C的物質的量分數與原平衡相等,恒溫恒容下,反應前后氣體體積不相等,按化學計量數轉化到左邊滿足n(A)=3mol、n(B)=1mol;
(2)①由(1)分析可知,隨反應進行混合氣體物質的量減小,恒溫恒容下平衡時壓強減小,若維持容器壓強不變,等效為在(1)中平衡基礎上增大壓強,平衡正向移動;
②改變起始物質加入的量,若轉化到方程式左邊滿足n(A):n(B)=3:1,恒溫恒壓下與原平衡為等效平衡,欲使反應達到平衡時C的物質的量是原平衡的2倍,則開始投入的A、B分別為原平衡起始投入量的2倍.
解答 解:一定溫度下,將3molA氣體和1molB氣體通入一密閉容器中,若容器體積固定為 2L,反應1min時測得剩余1.8mol A,C的濃度為0.4mol/L,則:
3A(g)+B(g)?x C(g)
起始量(mol):3 1 0
變化量(mol):1.2 0.4 0.4x
1min時(mol):1.8 0.6 0.4x
①0.4mol/L×2L=0.4x,則x=2,故答案為:2;
②后1min內速率小于前1min內反應速率,故后1min內C的濃度變化量小于0.4mol/L,故2min達到平衡,平衡時C的濃度小于0.8mol/L,故答案為:小于;
③令平衡時轉化的B為ymol,則:
3A(g)+B(g)?2 C(g)
起始量(mol):3 1 0
變化量(mol):3y y 2y
2min時(mol):3-3y 1-y 2y
所以$\frac{2y}{4-2y}$=22%,解得y=$\frac{22}{61}$,故A的轉化率為$\frac{3×\frac{22}{61}mol}{3mol}$×100%≈36.1%,
故答案為:36.1%;
④改變起始物質加入的量,欲使反應達到平衡時C的物質的量分數與原平衡相等,恒溫恒容下,反應前后氣體體積不相等,按化學計量數轉化到左邊滿足n(A)=3mol、n(B)=1mol,則:n(A)+1.5n(C)=3、n(B)+0.5n(C)=1,
故答案為:n(A)+1.5n(C)=3、n(B)+0.5n(C)=1;
(2)①由(1)分析可知,隨反應進行混合氣體物質的量減小,恒溫恒容下平衡時壓強減小,若維持容器壓強不變,等效為在(1)中平衡基礎上增大壓強,平衡正向移動,達到平衡時C的體積分數大于22%,
故答案為:大于;
②改變起始物質加入的量,若轉化到方程式左邊滿足n(A):n(B)=3:1,恒溫恒壓下與原平衡為等效平衡,欲使反應達到平衡時C的物質的量是原平衡的2倍,則開始投入的A、B分別為原平衡起始投入量的2倍,則應加入6molA氣體和2molB氣體,
故答案為:6;2.
點評 本題考查化學平衡計算與影響因素、等效平衡等,難度中等,(1)中②注意根據反應速率分析前、后1min內C的濃度變化量,理解等效平衡規律:1、恒溫恒容,反應前后氣體體積不等,按化學計量數轉化到一邊,對應物質滿足等量;反應前后氣體體積相等,按化學計量數轉化到一邊,對應物質滿足等比,2:恒溫恒壓,按化學計量數轉化到一邊,對應物質滿足等比.


科目:高中化學 來源: 題型:選擇題
| A. | 混合溶液中由水電離出的c(OH-)═10-8 mol•L-1 | |
| B. | c(Na+)═c(X-)+c(HX)=0.1mol•L-1 | |
| C. | c(Na+)-c(X-)═9.9×10-7mol•L-1 | |
| D. | c(OH-)-c(HX)═c(H+)=1×10-8mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Na+、Cl-、AlO2-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
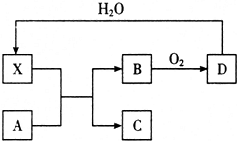 已知X為一種常見酸的濃溶液,能使蔗糖變黑.A與X反應的轉化關系如圖所示,其中反應條件及部分產物已略去,下列有關說法正確的是( )
已知X為一種常見酸的濃溶液,能使蔗糖變黑.A與X反應的轉化關系如圖所示,其中反應條件及部分產物已略去,下列有關說法正確的是( )| A. | X能使蔗糖變黑主要體現了 X的強氧化性 | |
| B. | 若A為鐵,則足量A與X在室溫下即可完全反應 | |
| C. | 若A為碳單質,則將C通入少量澄清石灰水中,最終一定有白色沉淀產生 | |
| D. | 工業上,B轉化為D的反應需使用催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | |
| B. | 2Na2O2+2CO2═2NaCO3+O2 | |
| C. | Na2O2+H2SO4(稀)═Na2SO4+H2O2 | |
| D. | Fe2O3+3Na2O2(熔融)═2Na2FeO4十Na2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學是在原子、分子水平上研究物質的組成、結構、性質、制備等的自然科學 | |
| B. | 化學是一門具有創造性的科學,可以利用化學知識創造出自然界中不存在的物質 | |
| C. | 化學的發展經過了從宏觀到微觀,從感性到理性的逐步深化的過程 | |
| D. | 隨著化學的發展,人們最終會實現通過化學變化使水變油的夢想 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
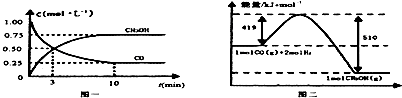
| 容器 | 反應物投入的量 | 反應物的 轉化率 | CH3OH的濃度 | 能量變化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ熱量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ熱量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol固態焦炭與1mol水蒸氣反應產生1mol一氧化碳和1mol氫氣,吸收131.3 kJ的熱量 | |
| B. | 碳與水反應吸收131.3 kJ的熱量 | |
| C. | 1mol碳和1mol水反應吸收131.3 kJ的熱量 | |
| D. | 固態碳和氣態水各1mol反應,放出131.3 kJ的熱量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com