

分析 (1)①根據v=$\frac{△c}{△t}$計算反應速率,在0-t1min內,NO2的物質的量濃度變化了(a-b)mol/L,2NO2(g)?N2O4(g),則N2O4的物質的量濃度變化了$\frac{a-b}{2}$mol/L;
②溫度越高,反應速率越大,溫度T1先到達平衡點,溫度T1>T2,根據在溫度T1、T2下,M點表示平衡狀態v正=v逆,N點表示未達平衡狀態,平衡正向進行v正>v逆分析;
③在恒容密閉容器中,M點表示平衡狀態,再加入一個定量NO2,2NO2(g)?N2O4(g),平衡向正反應方向進行,平衡后NO2的轉化率變大;
(2)N2O4與O2、H2O化合生成硝酸,根據得失電子守恒和原子守恒寫出反應的方程式;
(3)根據電解NO制備NH4NO3的反應方程式分析判斷,陽極反應為NO-3e-+2H2O=NO3-+4H+,陰極反應為:NO+5e-+6H+=NH4++H2O;
解答 解:(1)①由圖可知,T2下,在0-t1min內,NO2的物質的量濃度變化了(a-b)mol/L,則N2O4的物質的量濃度變化了$\frac{a-b}{2}$mol/L,故化學反應速率v(N2O4)=$\frac{△c}{△t}$=$\frac{a-b}{2{t}_{1}}$mol/(L•min),
故答案為:$\frac{a-b}{2{t}_{1}}$mol/(L•min);
②由圖可知,溫度T1先到達平衡點(先出現拐點),溫度T1>T2,所以在溫度T1、T2下,到達平衡時v1正>v2正,在溫度T1下,M點表示平衡狀態v1正=v1逆,N點表示未達平衡狀態,平衡正向進行v2正>v2逆,所以M點的正反應速率v正大于N點的逆反應速率v逆,
故答案為:大于;
③在恒容密閉容器中,增大壓強,平衡向體積縮小的方向移動,M點表示平衡狀態,再加入一個定量NO2,既增大了反應物的濃度,又增大了壓強,平衡正向移動,相對原平衡二氧化氮轉化率增大,
故答案為:變大;
(2)N2O4與O2、H2O化合生成硝酸,其反應的化學方程式為:2N2O4+O2+2H2O=4HNO3,
故答案為:2N2O4+O2+2H2O=4HNO3;
(3)電解NO制備NH4NO3,陽極反應為NO-3e-+2H2O=NO3-+4H+,陰極反應為:NO+5e-+6H+=NH4++H2O,從兩極反應可看出,要使得失電子守恒,陽極產生的NO3-的物質的量大于陰極產生的NH4+的物質的量,總反應方程式為:8NO+7H2O$\frac{\underline{\;電解\;}}{\;}$3NH4NO3+2HNO3,因此若要使電解產物全部轉化為NH4NO3,需補充NH3;
故答案為:NH3;根據得失電子守恒,陽極產生的NO3-的物質的量大于陰極產生的NH4+的物質的量,所以需補充NH3.
點評 本題考查了化學反應速率的計算、影響平衡的因素、化學方程式書寫、電解的應用等,題目涉及的知識點較多,側重于考查學生的綜合運用能力,題目難度中等,注意基礎知識的積累掌握.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
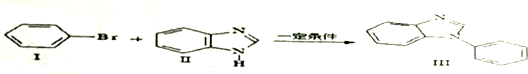
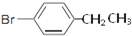 、
、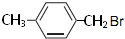 .
.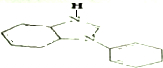 .
.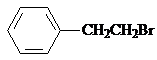 ,Ⅴ與氫氧化鈉醇溶液加熱條件下反應的方程式為:
,Ⅴ與氫氧化鈉醇溶液加熱條件下反應的方程式為: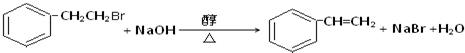 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素名稱 | 氟 | 氧 | 溴 | 碘 |
| 第一電離能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
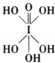 )和HIO4,前者為五元酸,后者為一元酸.請比較二者酸性強弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者為五元酸,后者為一元酸.請比較二者酸性強弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 肯定存在① | B. | 至少存在②和⑤ | C. | 無法確定是否有③ | D. | 至少存在①、④、⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溫度升高,c(H2PO4-)增大 | |
| B. | 加水稀釋后,m(H+)與m(OH-)的乘積減少 | |
| C. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| D. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩爾鹽 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1的Na2S溶液:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | |
| B. | 常溫下,pH=2的鹽酸和pH=12的氨水等體積混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1的NH4NO3溶液:c(NH4+)=c(NO3-) | |
| D. | 常溫下,pH=3的H2SO3溶液:c(H+)=c(HSO3-)=1×10-5mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
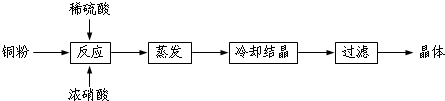
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 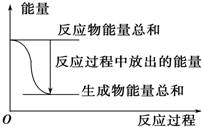 反應過程中能量關系可用如圖表示 | |
| B. | △H的值與反應方程式的計量系數有關 | |
| C. | 若將該反應設計成原電池,鋅為負極 | |
| D. | 若將其設計為原電池,當有32.5 g鋅溶解時,正極放出氣體一定為11.2 L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com