
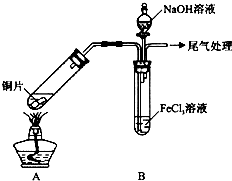
| 步驟② | 往5mL1mol•L-1 FeCl3溶液中通入SO2氣體,溶液立即變為紅棕色.微熱3min,溶液顏色變為淺綠色. |
| 步驟③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用濃鹽酸酸化)中通入SO2氣體,溶液立即變為紅棕色.幾分鐘后,發現溶液顏色變成淺綠色. |
分析 向FeCl3溶液中通人足量的SO2,再加入NaOH溶液,需先中溶液中的H+,在沉淀Fe2+,現象為開始沒有明顯現象,后有白色沉淀生成;結合電荷守恒和質量守恒,可以確定離子方程式:Fe3++H2O+Fe(HSO3)2+=2Fe2++SO42-+3H+;(5)均會發生反應生成Fe2+,加入K3[Fe(CN)6]生成藍色的鐵氰化亞鐵;通過實驗得出結論:加熱或提高FeCl3溶液的酸性會縮短淺綠色出現的時間,
(1)制取氣體的反應裝置,制取之前應檢查裝置的氣密性;二氧化硫尾氣用NaOH溶液吸收;
(2)據配制一定物質的量濃度的溶液需要的儀器分析;
(3)FeCl3溶液中通人足量的SO2,溶液最終呈淺綠色,為FeCl2溶液,溶液顯酸性;
(4)Fe(HSO3)2+離子可以將Fe3+還原為Fe2+,根據氧化還原反應特征書寫離子方程式;
(5)鐵氰化鉀溶液與二價鐵離子反應生成藍色的Fe3(Fe(CN)6)2;
(6)綜合上述實驗分析,升高溫度、提高FeCl3溶液的酸性會加快反應速率,縮短淺綠色出現的時間.
解答 解:(1)制取氣體的反應裝置,制取之前應檢查裝置的氣密性;二氧化硫尾氣用NaOH溶液吸收,
故答案為:氣密性;NaOH;
(2)配制100mL1mol/L FeCl3溶液,所需要的玻璃儀器有:燒杯、量筒、玻璃棒、膠頭滴管、100mL的容量瓶,
故答案為:膠頭滴管、100mL的容量瓶;
(3)溶液顯酸性,滴入NaOH溶液時,開始無現象,然后產生白色沉淀,
故答案為:開始無現象,然后產生白色沉淀;
(4)Fe(HSO3)2+離子可以將Fe3+還原為Fe2+,則由氧化還原反應有升必有降,則離子方程式為:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
故答案為:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
(5)鐵氰化鉀溶液與二價鐵離子反應生成藍色的Fe3(Fe(CN)6)2,所以所加試劑為鐵氰化鉀溶液K3[Fe(CN)6],
故答案為:K3[Fe(CN)6];
(6)綜合上述實驗分析,升高溫度、提高FeCl3溶液的酸性會加快反應速率,縮短淺綠色出現的時間,
故答案為:加熱或提高FeCl3溶液的酸性會縮短淺綠色出現的時間.
點評 本題為SO2的性質探究實驗,涉及裝置氣密性的檢驗,尾氣吸收,及物質的量濃度溶液的配制,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{bc}{a{N}_{A}}$ | B. | $\frac{ac}{b{N}_{A}}$ | C. | $\frac{ab}{c{N}_{A}}$ | D. | $\frac{b}{ac{N}_{A}}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含H+的溶液一定呈酸性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | c(OH-)═c(H+)的溶液一定呈中性 | |
| D. | 水中加入硫酸恢復至室溫后,Kw=c(H+)•c(OH-)將變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
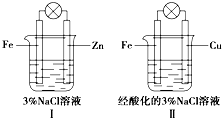
| A. | Ⅰ和Ⅱ中正極均被保護 | |
| B. | Ⅰ和Ⅱ中負極反應均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正極反應均是O2+2H2O+4e-═4OH- | |
| D. | Ⅰ和Ⅱ中燈泡均會發亮 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 電解原理在化學工業中有廣泛應用.下圖表示一個電解池,其中a為電解質溶液,X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
電解原理在化學工業中有廣泛應用.下圖表示一個電解池,其中a為電解質溶液,X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:| 方案 | X | Y | a溶液 |
| A | 銅 | 石墨 | CuSO4 |
| B | 銅 | 鐵 | CuSO4 |
| C | 鐵 | 銅 | Fe(NO3)3 |
| D | 鐵 | 銅 | CuSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗序號 | 1 | 2 | 3 |
| 滴定起始讀數(mL) | 0.75 | 0.50 | 0.80 |
| 滴定終點讀數(mL) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
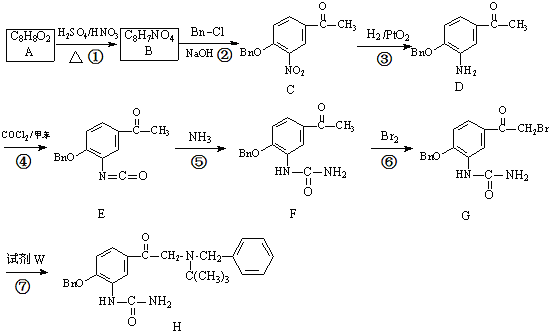
 試劑W
試劑W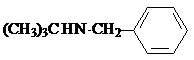 .
.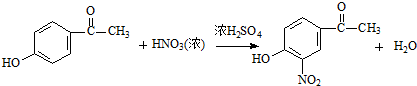 .
.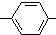 CH2
CH2 N=C=O生成高聚物的結構簡式
N=C=O生成高聚物的結構簡式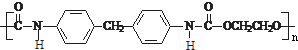 .
.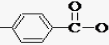 -CH2CH2N(C2H5)2(無機試劑任用)
-CH2CH2N(C2H5)2(無機試劑任用) 查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化合物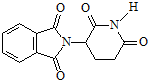 的分子式為C13H9O4N2 的分子式為C13H9O4N2 | |
| B. | 在堿性條件下,CH3CO18OC2H5的水解產物是CH3COOH和C2H518OH | |
| C. | 在一定條件下,乙酸、氨基乙酸、蛋白質均能與NaOH發生反應 | |
| D. | 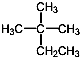 的系統命名為2-甲基-2-乙基丙烷 的系統命名為2-甲基-2-乙基丙烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O═H2SO4+2HI | ||
| C. | H2O2+H2SO4═SO2+O2↑+H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com