
| A. | CO(g) 與Na2O2(s)反應放出509kJ熱量時,電子轉移數為6.02×1023 | |
| B. | 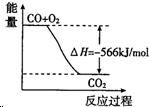 圖可表示由CO生成CO2的反應過程和能量關系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452kJ/mol | |
| D. | CO的燃燒熱為283kJ |
分析 A.依據熱化學方程式,結合蓋斯定律計算得到熱化學方程式計算分析;
B.根據“短線上說明的物質”不僅僅代表的是反應物或者生成物,而其對應的系數代表的是參加反應的物質的量;
C.根據熱化學方程式中熱量與物質的量之間的關系、物質由固態變氣態吸收熱量以及蓋斯定律來解答;
D.根據燃燒熱的概念以及燃燒熱的單位分析,CO的燃燒熱為283 kJ/mol.
解答 解:A.題目中$\frac{1式}{2}$+2式為:Na2O2(s)+CO(g)=Na2CO3(s)△H=-509 kJ/mol,此時放熱509KJ,因為CO是1mol,所以轉移電子數是2倍的6.02×1023,故A錯誤;
B.該圖描述的就是一個熱化學方程式,所以對應566的數值應該是2CO(g)+O2(g)和2CO2,上邊的系數不對,故B錯誤;
C.題目中第二個方程的2倍為:2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452 kJ/mol,本題中的CO2(s)多一步變氣體吸熱的過程,所以本題放出的熱量就少于452,但是△H>-452 kJ/mol,故C正確;
D.燃燒熱是1mol可燃物完全燃燒生成穩定氧化物時放出熱量,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;一氧化碳的燃燒熱為283KJ/mol,故D錯誤;
故選C.
點評 本題考查了熱化學方程式的計算應用,蓋斯定律的應用,燃燒熱概念計算分析,熱化學方程式的書寫方法和計算應用是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
| 實驗步驟、預期現象 | 結論 |
| ①向溶液中加入四氯化碳,操作振蕩、靜置, 現象CCl4層呈橙紅色,水層呈無色 | 假設1正確 |
| ②向溶液中另入KSCN溶液, 現象溶液變為紅色 | 假設2正確 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
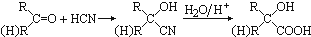 ,CO和H2按物質的量之比1:2可以制得G,有機玻璃可按下列路線合成:
,CO和H2按物質的量之比1:2可以制得G,有機玻璃可按下列路線合成: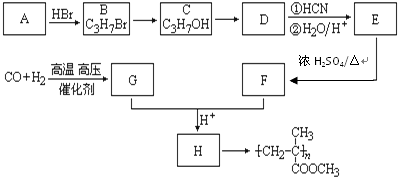
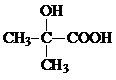 ;
; ;
;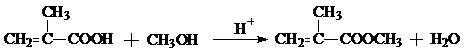 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 應選用100mL容量瓶 | |
| B. | 配置之前容量瓶中殘留的蒸餾水會導致濃度偏高 | |
| C. | 定容時腐蝕刻度會導致濃度偏低 | |
| D. | 搖勻、靜置后發現凹液面低于刻度線,再加水至刻度線即可 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮可以形成多種化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多種化合物,如NH3、N2H4、HCN、NH4NO3等.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
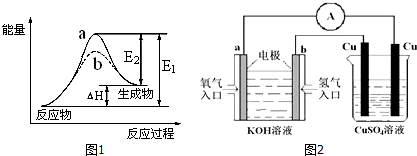
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com