
 (1)第一電離能介于B、N之間的第二周期元素有3種.
(1)第一電離能介于B、N之間的第二周期元素有3種.分析 (1)同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大的趨勢,但第ⅡA元素第一電離能大于第ⅢA元素,第ⅤA族的第一電離能大于第ⅥA族元素;
(2)根據共用電子對偏向電負性大的原子進行解答;
(3)Fe3C晶體中碳元素為-3價,則其中基態鐵離子的電子排布式為:[Ar]3d64s1;
(4)根據δ鍵和孤對電子數判斷分子的立體構型以及鍵角;
(5)根據價電子對數判斷其雜化類型,根據形成的雜化軌道判斷其空間構型;
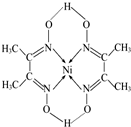
(6)①根據圖可知,碳氮之間為雙鍵,其中之一為π鍵,氮和鎳之間電子對由氮原子單方面提供為配位鍵,其它都為共價鍵,據此答題;
②其分子中碳原子的雜化方式為sp2和sp3.
解答 解:(1)同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大的趨勢,但第ⅡA元素第一電離能大于第ⅢA元素,第ⅤA族的第一電離能大于第ⅥA族元素,所以第二周期中第一電離能順序為:Li<B<Be<C<O<N,第一電離能介于B、N之間的第二周期元素有Be、C、O三種元素;
故答案為:3;
(2)共用電子對偏向電負性大的原子,CH4中共用電子對偏向C,則電負性C>H;SiH4中共用電子對偏向H,則電負性H>Si,所以C、Si、H的電負性大小關系為:C>H>Si,
故答案為:C>H>Si;
(3)Fe3C晶體中碳元素為-3價,則其中基態鐵離子的電子排布式為:[Ar]3d64s1,故答案為:[Ar]3d64s1;
(4)甲醇分子內碳原子形成4個σ鍵,雜化方式為sp3雜化,鍵角小于120°,甲醛分子內碳原子形成3個σ鍵,雜化方式為2雜化,鍵角為120°;所以甲醇(CH3OH)分子內的O-C-H鍵角 小于甲醛(H2C═O)分子內的O-C-H鍵角;
故答案為:小于;
(5)BF3中價電子對數為:$\frac{3+3}{2}$=3,形成了三條雜化軌道,即B的雜化類型為sp2,形成3個共用電子對,無孤對電子.為平面三角形;NF3中價電子對數為:$\frac{5+3}{2}$=4,形成了四條雜化軌道,即N的雜化類型為sp3,形成3個共用電子對,還有一對孤對電子,因而為三角錐形;
故答案為:BF3中B的雜化類型為sp2,形成3個共用電子對,無孤對電子.為平面三角形;NF3中N的雜化類型為sp3,形成3個共用電子對,還有一對孤對電子,因而為三角錐形;
(6)①根據圖b可知,碳氮之間為雙鍵,其中之一為π鍵,氮和鎳之間電子對由氮原子單方面提供為配位鍵,其它都為共價鍵,故答案為:AC;
②其分子中碳原子的雜化方式為sp2和sp3,故答案為:sp2和sp3.
點評 本題考查電離能、電負性、核外電子排布,分子構型的判斷,難度不大,應根據價電子對數=孤電子對數+共價鍵數判斷.


 口算能手系列答案
口算能手系列答案科目:高中化學 來源: 題型:選擇題
| A. | 離子晶體中只有離子鍵 | |
| B. | 非金屬元素只能形成共價鍵 | |
| C. | 水分子中存在氫鍵,所以水的沸點較高 | |
| D. | 原子晶體的熔點不一定比金屬晶體的熔點高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O2和酸性氯化亞鐵溶液反應:2Fe2++H2O2+2 H+═2Fe3++2H2O | |
| B. | 碳酸氫鎂溶液中加入過量石灰水:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 3 mol的Cl2通入含2 mol FeI2的溶液中:2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2 | |
| D. | 將SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O═CaSO3+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁制容器可盛裝熱的濃H2SO4 | |
| B. | AgI膠粒在電場中自由運動 | |
| C. | K與水反應比Li與水反應劇烈 | |
| D. | 鉛蓄電池在放電過程中,負極質量減小,正極質量增加 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol硫酸鋁鉀中陰離子所帶電荷總數為2NA | |
| B. | 等質量的乙炔和苯分別完全燃燒,乙炔和苯都消耗7.5NA個氧氣分子 | |
| C. | 將0.1mol碳酸鈉溶于1L水中,所得溶液含有CO32-和HCO3-共0.1NA個 | |
| D. | 在H2O2作燃料電池的負極原料時,每摩爾H2O2轉移的電子數為2 NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com