
分析 (1)硫酸為強電解質,完全電離產生氫離子與硫酸根離子,用等號;
(2)氫氧化鋇為強電解質,完全電離產生鋇離子和氫氧根離子,用等號;
(3)次氯酸鈉為強電解質,完全電離產生鈉離子和次氯酸根離子,用等號.
解答 解:(1)硫酸為強電解質,完全電離產生氫離子與硫酸根離子,電離方程式:H2SO4=2H++SO42-,
故答案為:H2SO4=2H++SO42-;
(2)氫氧化鋇為強電解質,完全電離產生鋇離子和氫氧根離子,電離方程式:Ba(OH)2=Ba2++2OH-,
故答案為:Ba(OH)2=Ba2++2OH-;
(3)次氯酸鈉為強電解質,完全電離產生鈉離子和次氯酸根離子,電離方程式:NaClO=Na++ClO-;
故答案為:NaClO=Na++ClO-;
點評 本題考查了電解質電離方程式的書寫,明確電解質的強弱及電離方程式書寫方法即可解答,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 燒堿是強電解質,在水溶液中完全電離 | |
| B. | 將水加熱,水的電離平衡向正反應方向移動,Kw變大 | |
| C. | 向溶液中加酸、加堿都能抑制水的電離 | |
| D. | 根據溶液導電能力強弱,將電解質分為強電解質、弱電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷在氧氣中燃燒 | |
| B. | 稀硫酸和氫氧化鈉溶液發生中和反應 | |
| C. | 金屬鈉和水反應 | |
| D. | Ba(OH)2•8H2O晶體與NH4Cl晶體反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合氣體的壓強 | B. | 混合氣體的密度 | C. | B的物質的量濃度 | D. | 物質A的質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol任何氣體的體積都約為22.4L | |
| B. | 0.1mol/L 的NaCl溶液中,Na+與Cl-離子總數為0.2NA | |
| C. | 在標準狀況下,2mol酒精的體積約為44.8L | |
| D. | 常溫常壓下,質量為32g的O2含有的分子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molH2的體積為22.4L | |
| B. | Na+的摩爾質量是23 g/mol | |
| C. | 標準狀況下,22.4 L水中含有的水分子數為NA | |
| D. | 標準狀況下,將22.4LHCl溶于1L水中,其物質的量濃度為1mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Hg(NO3)2溶于水,可將含有Hg(NO3)2的廢液倒入水池中,再用水沖入下水道 | |
| B. | 用蒸發方法使NaCl從溶液中析出時,應將蒸發皿中NaCl溶液全部蒸干才停止加熱 | |
| C. | 用濃硫酸配制一定物質的量濃度的稀硫酸時,濃硫酸溶于水后,必須冷卻至室溫才能轉移到容量瓶中 | |
| D. | 分液操作時,下層液體從分液漏斗下口放出,上層液體從下口放出到另一個燒杯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.3mol/L的MgCl2溶液和0.2mol/L的AlCl3中Cl-的物質的量濃度不相同 | |
| B. | 氧化還原反應過程中一定存在電子的得失或共用電子對的偏移 | |
| C. | 無論什么狀況下,質量一定的某種氣體含有的分子數是一定的 | |
| D. | 相同狀況下,氣體的相對分子質量越大則氣體密度越大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
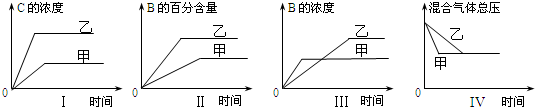
| A. | 圖I研究的是不同催化劑對反應的影響,且乙使用的催化劑效率較高 | |
| B. | 圖Ⅱ研究的是壓強對反應的影響,且乙的壓強較高 | |
| C. | 圖Ⅲ研究的是溫度對反應的影響,且甲的溫度較高 | |
| D. | 圖IV 研究的是不同催化劑對反應的影響,且甲使用的催化劑效率較高 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com