
【題目】下圖是某工業生產過程。

溶解度表:
溫度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化銨 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸銨 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸鉀 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化鉀 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工業生產過程的目標產品是____________________________________。(寫化學式)
(2)過濾Ⅰ操作所得固體中,除CaCO3外還有一種物質,該固體的用途有_________(試舉一例)。
(3)根據溶解度表轉化Ⅱ適宜的溫度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
過濾Ⅱ操作所得濾渣是__________。
(4)我國著名的化學家也利用了轉化Ⅱ的反應原理制備了一種重要的堿,該制備的化學反應方程式為:___________________________________________________
(5)氯化鈣結晶水合物(CaCl2·6H2O)進行脫水處理可制得常用的干燥劑,根據下圖選擇最佳脫水的方法是__________

A、氯化氫氣流中加熱到174℃ B、直接加熱至174℃
C、直接加熱至260℃ D、氯化氫氣流中加熱到260℃
(6)上述工業流程實現了綠色化學的理念,其中__________________(填化學式)實現了循環利用,副產品_________________________(填化學式)可轉化為原料,整個流程基本實現了污染物零排放。
【答案】 CaCl2·6H2O 做石膏模型;加入到水泥中調節水泥的硬化速率;做建筑材料 D K2SO4(或K2SO4 和KCl) NH3+H2O+NaCl+CO2=NH4Cl+NaHCO3↓ C NH3 CaCO3
【解析】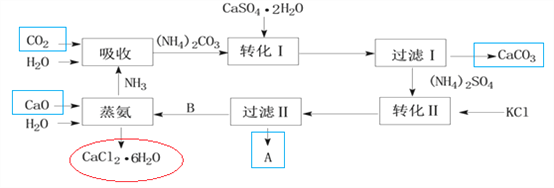
(1)根據上面流程,起點由水吸收氨氣,再吸收二氧化碳,最后轉化產出的為紅色圈的CaCl2·6H2O,本工業生產過程的目標產品是CaCl2·6H2O;而箭頭指出的CaCO3受熱分解可提供氧化鈣和二氧化碳,根據溶解性表中硫酸銨、氯化鉀、硫酸鉀和氯化銨中硫酸鉀溶解度最小,在轉化Ⅱ中溶解度最小的先析出,故過濾Ⅱ濾渣A為硫酸鉀,即箭頭指出的在流程序中間的碳酸鈣和硫酸鉀都不是目標產品;(2)過濾Ⅰ操作所得固體中,除CaCO3外還有一種物質,根據前面轉化Ⅰ加入的石膏應該過量且是微溶,故還有的固體為石膏,用途有:做石膏模型;加入到水泥中調節水泥的硬化速率;做建筑材料等;(3)根據溶解度表轉化Ⅱ適宜的溫度是90~100℃,該溫度范圍內,硫酸銨、氯化鉀、氯化銨的溶解度都比硫酸鉀溶解度大得多,容易析出硫酸鉀晶體;過濾Ⅱ操作所得濾渣是K2SO4(或K2SO4 和KCl);(4)我國著名的化學家也利用了轉化Ⅱ的反應原理制備了一種重要的堿,該制備是在飽和食鹽水中通入足量的氨氣,再通入足量的二氧化碳產生碳酸氫鈉,化學反應方程式為:NH3+H2O+NaCl+CO2=NH4Cl+NaHCO3↓;(5)由于CaCl2·6H2O的相對分子質量為219、假如有CaCl2·4H2O、CaCl2·2H2O、CaCl2·H2O、,則相對分子質量分別為183、147、129,CaCl2的相對分子質量為111,根據相對分子質量及質量關系,將CaCl2·6H2O轉化為CaCl2最佳脫水的方法是應該選D;(6)上述工業流程(參照前面的圖)實現了綠色化學的理念,其中蒸氨過程中NH3實現了循環利用,副產品CaCO3可轉化為原料氧化鈣和二氧化碳,整個流程基本實現了污染物零排放。


科目:高中化學 來源: 題型:
【題目】如圖,在盛有溴水的三支試管中分別加入苯、四氯化碳和酒精,振蕩后靜置,出現下列現象,正確的結論是( ) 
A.①加入的是CCl4 , ②加入苯,③加酒精
B.①加入的是酒精,②加入CCl4 , ③加苯
C.①加入的是苯,②加入CCl4 , ③加酒精
D.①加入的是苯,②加酒精,③加CCl4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇(CH3OH)是一種新型清潔能源。回答問題:
(1)101KPa、25℃時,燃燒32g液態甲醇生成液態水和二氧化碳放熱726.5kJ,則甲醇燃燒的熱化學方程式為_____________
已知:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=-24.5kJ·mol-1
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1
CH3OH(g) △H=akJ·mol-1
則2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) △H=__________
(2)工業上可用CO和H2制取甲醇,其熱化學反應方程式為:CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1,CO在不同溫度下的平衡轉化率與壓強的關系如下圖所示
CH3OH(g) △H=akJ·mol-1,CO在不同溫度下的平衡轉化率與壓強的關系如下圖所示
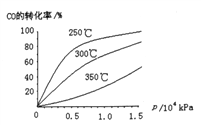
①△H______0(填“﹥”或“<”).判斷依據是___________________
②為提高CO轉化率,可采取的措施是_____________________________(至少答出兩條)
③實際生產中,反應的條件控制在250℃,1.3×104kPa左右,選擇此壓強的理由是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cl2是一種有毒氣體,如果泄漏會造成嚴重的環境污染.化工廠可用濃氨水來檢驗Cl2 是否泄漏,有關反應的化學方程式為:3Cl2(氣)+8NH3(氣)═6NH4Cl(固)+N2(氣)
①用雙線橋法標出電子轉移的方向和數目
②若反應中消耗Cl21.5mol則被氧化的NH3在標準狀況下的體積為 L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 反應NH3(g)+HCl(g)![]() NH4Cl(s)能自發進行,則該反應△H>0
NH4Cl(s)能自發進行,則該反應△H>0
B. 氨水溶液加水稀釋后,溶液中 的值減小
的值減小
C. 1L1 molL-1的NaClO溶液中含有ClO-的數目為6.02×1023
D. 一定條件下,反應2SO2(g)+O2(g)![]() 2SO3(g)△H<0達到平衡后,升高體系溫度,反應重新達到平衡前,有2v正(O2)>v逆(SO3)
2SO3(g)△H<0達到平衡后,升高體系溫度,反應重新達到平衡前,有2v正(O2)>v逆(SO3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:2A(s)![]() B(g)+C(g)在體積固定的密閉容器中,起始時加入一定量的A,判斷反應達到平衡狀態的標志是: ①單位時間內生成2molA的同時生成1molB ②v(B):v(C)=1:1 ③密閉容器中混合氣體的平均摩爾質量不變 ④混合氣體的密度不再改變 ⑤B的體積分數不再改變 ⑥混合氣體的壓強不再改變的狀態
B(g)+C(g)在體積固定的密閉容器中,起始時加入一定量的A,判斷反應達到平衡狀態的標志是: ①單位時間內生成2molA的同時生成1molB ②v(B):v(C)=1:1 ③密閉容器中混合氣體的平均摩爾質量不變 ④混合氣體的密度不再改變 ⑤B的體積分數不再改變 ⑥混合氣體的壓強不再改變的狀態
A. ①③④⑤⑥ B. ①③④⑥ C. ①④⑥ D. 全部
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com