
【題目】實驗室利用硫酸廠燒渣(主要成分為鐵的氧化物及少量FeS、SiO2等)制備聚鐵(堿式硫酸鐵的聚合物)和綠礬(FeSO4·7H2O),過程如下:
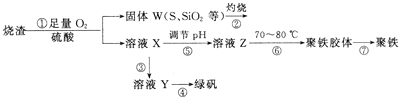
(1)將過程②中產生的氣體通入下列溶液中,溶液不會褪色的是_____(填標號)。
A.品紅溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)過程①中,FeS和O2、H2SO4反應的離子方程式為_________。
(3)過程③中,需加入的物質是__________。
(4)實驗室為測量所得到的聚鐵樣品中鐵元素的質量分數,進行下列實驗。①用分析天平稱取2. 800 g樣品;②將樣品溶于足量的鹽酸后,加入過量的氯化鋇溶液;③過濾、洗滌、干燥,稱量,得固體質量為3. 495 g。若該聚鐵主要成分為[Fe(OH) (SO4)]n,則該聚鐵樣品中鐵元素的質量分數為____________(假設雜質中不含鐵元素和硫元素)。
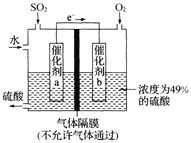
(5)如圖是將過程②產生的氣體SO2轉化為重要的化工原料H2SO4的原理示意圖,若得到的硫酸濃度仍為49%,則理論上參加反應的SO2與加入的H2O的質量比為______。
【答案】B 4 FeS+3O2+12 H+=== 4Fe3++6H2O+4S Fe(或鐵) 30% 8 : 15
【解析】
過程②產生的氣體為![]() ,具有還原性和漂白性;根據反應物和生成物的種類結合質量守恒書寫化學方程式;溶液X中含有
,具有還原性和漂白性;根據反應物和生成物的種類結合質量守恒書寫化學方程式;溶液X中含有![]() ,要制備綠礬,應加入
,要制備綠礬,應加入![]() 使之還原為
使之還原為![]() ;
;
(1)過程②產生的氣體為![]() ,具有還原性和漂白性,因具有漂白性而使品紅褪色,因具有還原性而使具有氧化性的酸性
,具有還原性和漂白性,因具有漂白性而使品紅褪色,因具有還原性而使具有氧化性的酸性![]() 溶液、溴水褪色,只有紫色石蕊試液不會褪色。
溶液、溴水褪色,只有紫色石蕊試液不會褪色。
故答案為:B;
(2)反應物為![]() 、
、![]() 和
和![]() ,生成物有
,生成物有![]() ,根據質量守恒還應有
,根據質量守恒還應有![]() 和
和![]() ,反應的離子方程式為
,反應的離子方程式為![]() ,
,
故答案為:![]() ;
;
(3)溶液X中含有![]() ,要制備綠礬,應加入
,要制備綠礬,應加入![]() 使之還原為
使之還原為![]() ,加入鐵可生成
,加入鐵可生成![]() ,并且不引入新的雜質,
,并且不引入新的雜質,
故答案為:Fe(或鐵);
(4)過濾、洗滌、干燥,稱量,得固體質量為3.495g,應為BaSO4沉淀,![]() ,則
,則![]() ,
,![]() ,該聚鐵樣品中鐵元素的質量分數
,該聚鐵樣品中鐵元素的質量分數![]() ,
,
故答案為:30%
(5)原硫酸濃度為49%,得到的硫酸濃度仍為49%,所以新生成的硫酸的質量比后加入物質的總質量為49%,總方程式為:![]() ,加入
,加入![]() 的質量為x g,加入水的質量為y g,需要通入氧氣的質量為:
的質量為x g,加入水的質量為y g,需要通入氧氣的質量為:![]() g,新生成硫酸的質量為
g,新生成硫酸的質量為![]() g,故
g,故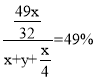 ,解得
,解得![]() ,
,
故答案為:8 : 15。


 出彩同步大試卷系列答案
出彩同步大試卷系列答案科目:高中化學 來源: 題型:
【題目】K2 FeO4在水中不穩定,發生反應:![]() +l0H2O
+l0H2O![]() 4Fe(OH)3(膠體)+8OH-+3O2,其穩定性與溫度(T)和溶液pH的關系分別如下圖所示。下列說法不正確的是 ( )
4Fe(OH)3(膠體)+8OH-+3O2,其穩定性與溫度(T)和溶液pH的關系分別如下圖所示。下列說法不正確的是 ( )
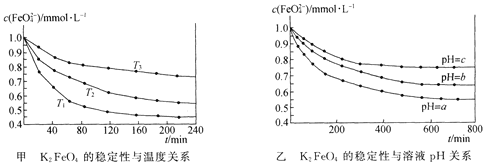
A.由圖甲可知上述反應 △H < 0
B.由圖甲可知溫度:T1 > T2 > T3
C.由圖甲可知K2 FeO4的穩定性隨溫度的升高而減弱
D.由圖乙可知圖中a < c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有A、B、C、D、E五種短周期元素,已知A、B、C、D四種元素的核內質子數之和為56,在元素周期表中的位置如圖所示,1 mol E的單質可與足量酸反應,能產生33.6 L H2(在標準狀況下);E的陽離子與A的陰離子核外電子層結構相同。
A | ||
B | C | D |
回答下列問題:
(1)寫出下列元素名稱A__________,B___________,E____________
(2)C的簡單離子結構示意圖為_____________
(3)B單質在A單質中燃燒,反應現象是__________________________________,生成物的化學式為___________
(4)A與E形成的化合物的化學式為__________,它的性質決定了它在物質的分類中應屬于__________________
(5)向D與E形成的化合物的水溶液中滴入燒堿溶液至過量,此過程中觀察到的現象是_______________________,寫出有關化學反應方程式______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法不正確的是
A.一定條件下,合成氨反應中有0.5molN2發生反應,則反應中轉移電子數為3NA
B.10克環己烷與2-丙醇的混合液中,碳元素的質量分數為72%,則其中所含的氧原子數目為![]() NA
NA
C.12g石墨中含有3NA個C-C共價鍵
D.常溫常壓下有28g單晶硅晶體,則其中所含的Si﹣Si鍵數目為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2017年5月18日中國地質調查局宣布,我國在南海進行的可燃冰試采獲得成功,成為全球第一個獲得可燃冰連續穩定產氣的國家。可燃冰是天然氣與水相互作用形成的晶體物質,主要存在于凍土層和海底大陸架中。下列說法正確的是( )

①甲烷屬于烴類;②相同條件下,甲烷的密度大于空氣的密度;③甲烷難溶于水;④可燃冰是一種極具潛力的能源;⑤青藏高原可能存在巨大體積的“可燃冰”
A.①③④⑤B.②③④⑤C.①②③⑤D.①②④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右圖是一種檢驗某氣體化學性質的實驗裝置,圖中B為開關。 如先打開B,在A處通入干燥氯氣,C中紅色布條顏色無變化;當關閉B時,C處紅色布條顏色褪去。則D瓶中盛有的溶液是( )
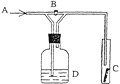
A.濃H2SO4 B.飽和食鹽水C.濃NaOH溶液D.KI溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子反應方程式正確的是
A.向NaAlO2溶液中通入過量CO2制Al(OH)3:2![]() +CO2+3H2O=2Al(OH)3↓+
+CO2+3H2O=2Al(OH)3↓+![]()
B.用硫酸酸化的淀粉碘化鉀溶液在空氣中變藍:4I-+O2+4H+=2I2+2H2O
C.漂白粉溶液通入少量SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
D.Na2O2溶于水產生O2:Na2O2+H2O=2Na++2OH-+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(227℃,1個大氣壓時),1.5L某烴蒸汽能在aL氧氣中完全燃燒,體積增大到(a+3)L(相同條件下),問:
(1)該烴在組成上必須滿足的基本條件是____________________
(2)當a=10L時,該烴可能的分子式__________________
(3)當該烴的分子式為C7H8時,a的取值范圍為____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組用凱氏定氮法(Kjeldahl method)來測定農產品中氮的含量,測定過程如下:
I.用熱濃硫酸處理0.25g谷物樣品,把有機氮轉化為銨鹽。
II.用下圖所示裝置處理上述銨鹽(夾持裝置略去)。
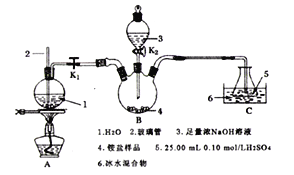
回答下列問題:
(1)實驗前要檢驗B裝置的氣密性,具體操作為______________________________。
(2)盛放氫氧化鈉溶液的儀器名稱為__________________;玻璃管2的作用是___________________;圓底燒瓶中碎瓷片的作用是_________________________________________。
(3)將“谷物處理后所得的銨鹽”加入三頸瓶中,打開玻璃塞、旋開K2,加入足量氫氧化鈉溶液,關閉K2,打開K1,點燃酒精燈使水蒸氣進入B裝置。
①B裝置中反應的離子方程式為_______________________________。
②C裝置冰水混合物的作用是__________________________________。
III.滴定、計算氮的含量
(4)取下錐形瓶,加入指示劑,用0.10mol/L的NaOH溶液滴定,重復滴定3次,平均消耗19.30mLNaOH溶液。
①該滴定的指示劑應選擇____________________。
a.甲基橙 b.配酞 c.甲基橙或酚酞
②該谷物樣品中氮的百分含量為_____________。(保留2位小數)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com