
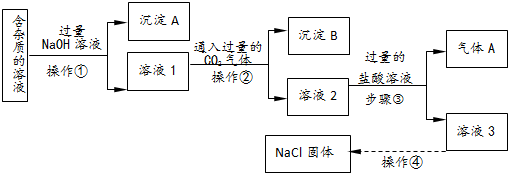
分析 由實驗流程可知,含有少量AlCl3、MgCl2、CuCl2雜質的NaCl溶液,加入過量的NaOH,生成沉淀A為Mg(OH)2、Cu(OH)2,和溶液1為NaAlO2、NaCl、NaOH的混合溶液,通入過量的二氧化碳,得到沉淀B為Al(OH)3,溶液2為NaCl、NaHCO3的混合溶液,再在混合溶液中加入鹽酸生成氣體A為,溶液3為NaCl、HCl的混合溶液,再經過蒸發結晶可得氯化鈉固體,以此解答該題.
解答 解:由實驗流程可知,含有少量AlCl3、MgCl2、CuCl2雜質的NaCl溶液,加入過量的NaOH,生成沉淀A為Mg(OH)2、Cu(OH)2,和溶液1為NaAlO2、NaCl、NaOH的混合溶液,通入過量的二氧化碳,得到沉淀B為Al(OH)3,溶液2為NaCl、NaHCO3的混合溶液,再在混合溶液中加入鹽酸生成氣體A為,溶液3為NaCl、HCl的混合溶液,再經過蒸發結晶可得氯化鈉固體,
(1)由以上分析可知,沉淀A的主要成分是Mg(OH)2、Cu(OH)2,
故答案為:Mg(OH)2、Cu(OH)2;
(2)操作①?因故分離固體和液體,為過濾操作,故答案為:過濾;
(3)①反應剩余的NaOH和過量的CO2發生反應的化學方程式為NaOH+CO2=NaHCO3,故答案為:NaOH+CO2═NaHCO3;
(4)步驟③為碳酸氫鈉與鹽酸的反應,反應的離子方程式是HCO3-+H+═H2O+CO2↑,故答案為:HCO3-+H+═H2O+CO2↑;
(5)操作④由溶液得到晶體,為蒸發操作,用到的儀器有玻璃棒、火柴、酒精燈、帶鐵圈的鐵架臺和蒸發皿,
故答案為:蒸發; 蒸發皿.
點評 本題考查物質的分離提純操作方法,為高頻考點,側重于學生的分析、實驗能力的考查,題目難度中等,解答時注意明確Cl-、SO42-的性質,把握除雜原則,提純時不能引入新的雜質,注意把握實驗的先后順序.


科目:高中化學 來源: 題型:選擇題
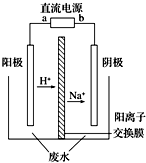 最近有研究人員發現了一種處理高濃度乙醛廢水的新方法--隔膜電解法,乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸.實驗室以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置如圖所示.下列說法正確的是( )
最近有研究人員發現了一種處理高濃度乙醛廢水的新方法--隔膜電解法,乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸.實驗室以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置如圖所示.下列說法正確的是( )| A. | 電解過程中,陰極區消耗Na+ | |
| B. | 陽極反應為CH3CHO-2e-+2H+═CH3COOH+H2O | |
| C. | 電解的總反應方程式為2CH3CHO+H2O$\frac{\underline{\;電解\;}}{\;}$CH3COOH+CH3CH2OH | |
| D. | 若以CH4-空氣燃料電池為直流電源,燃料電池的b極應通入空氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同條件下水溶液的pH:Na2CO3>Na2SO4 | |
| B. | 酸性:H2SO3>H2CO3 | |
| C. | CH4比NH3更穩定 | |
| D. | C與H2的化合價比N2與H2的化合更容易 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
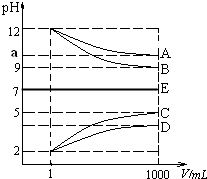 物質A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中離子兩兩組成(離子可重復,如NaCl、HCl).常溫下將各物質的溶液從1mL稀釋到1000mL,pH的變化如甲圖所示.請回答:
物質A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中離子兩兩組成(離子可重復,如NaCl、HCl).常溫下將各物質的溶液從1mL稀釋到1000mL,pH的變化如甲圖所示.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=8.3 的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] | |
| B. | 將pH=4的醋酸溶液稀釋后,溶液中所有離子的濃度均降低 | |
| C. | 中和pH與體積均相同的鹽酸和醋酸溶液,消耗NaOH的物質的量相同 | |
| D. | 常溫下,同濃度的Na2S與NaHS溶液相比,Na2S溶液為pH大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
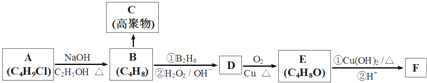
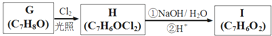
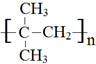 ,
,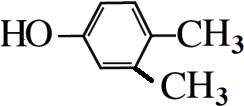 .
.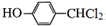 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaCl+2H2O.
+2NaCl+2H2O.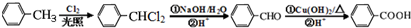 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵和酸反應,放出標準狀況下的22.4L氣體,轉移的電子數必為2NA | |
| B. | 將標準狀況下,11.2LN2和33.6LH2混合,在一定條件下充分反應,產生的NH3的分子數為2NA | |
| C. | 常溫常壓下,6g乙酸所含共價鍵數目為0.7NA | |
| D. | 1L 0.1mol•L-1碳酸鈉溶液中,陰離子數目大于0.1NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com