
【題目】下列儀器①漏斗②容量瓶③蒸餾燒瓶④天平⑤分液漏斗⑥量筒⑦燃燒匙。常用于物質分離的是
A. ①②⑥ B. ①③④ C. ①③⑤ D. ③④⑦
 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】下列反應中,通入的氣體物質只作為氧化劑的是
A.二氧化硫通入溴水溶液中B.氯氣通入氯化亞鐵溶液中
C.一氧化碳氣體通入灼熱的CuO中D.二氧化氮通入水中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種熔融碳酸鹽燃料電池原理示意如圖。下列有關該電池的說法正確的是( )
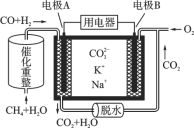
A. 反應CH4+H2O![]() 3H2+CO,每消耗1 mol CH4 轉移2 mol 電子
3H2+CO,每消耗1 mol CH4 轉移2 mol 電子
B. 電極A上H2參與的電極反應為:H2+2OH--2e-===2H2O
C. 電池工作時,CO32-向電極B移動
D. 電極B上發生的電極反應為:O2+2CO2+4e-===2CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在甲、乙、丙、丁四個恒容密閉容器中投入H2和I2,發生反應:H2(g)+I2(g) ![]() 2HI(g)。反應體系中各物質濃度的有關數據如下。
2HI(g)。反應體系中各物質濃度的有關數據如下。
容器 | 起始濃度 | 平衡濃度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判斷不正確的是
A. HI的平衡濃度:a=b>0.004,c=0.008 B. 平衡時,H2的轉化率:丁>甲
C. 平衡時,乙中H2的轉化率大于20% D. 丙中條件下,該反應的平衡常數K=0.25
查看答案和解析>>
科目:高中化學 來源: 題型:
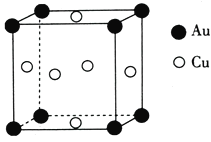
【題目】銅的相關化合物在生產生活中具有重要的作用。回答下列問題:
(1)銅元素在周期表中的位置是______,基態銅原子中,核外電子占據最高能層的符號是______,占據該最高能層的電子數為__________。
(2)在一定條件下,金屬相互化合形成的化合物稱為金屬互化物,如Cu9Al4、Cu5Zn8等。某金屬互化物具有自范性,原子在三維空間里呈周期性有序排列,該金屬互化物屬于__________(填“晶體”或“非晶體”)。
(3)銅能與類鹵素[(SCN)2]反應生成Cu(SCN)2,1mol(SCN)2分子中含有σ鍵的數目為_____________。硫氰酸(H-S-C≡N)和異硫氰酸(H-N=C=S),這兩種酸中沸點較高的是異硫氰酸(H-N=C=S)。理論上前者沸點低于后者,其原因是____________________________。
(4)銅晶體中銅原子的堆積方式為面心立方堆積,每個銅原子周圍距離最近的銅原子個數為________。
(5)銅與金形成的金屬互化物的晶胞結構如圖所示,其晶胞邊長為a nm,該金屬互化物的密度為____![]() 用含a、NA的代數式表示)gcm-3。
用含a、NA的代數式表示)gcm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設阿伏加德羅常數的值為NA,下列說法正確的是
A. 標準狀況下,2.24LCH3OH分子中共價鍵的數目為0.5NA
B. 1molNa2O2與足量CO2充分反應,轉移的電子數為2 NA
C. 用濃鹽酸分別和KMnO4、KClO3反應制備l mol氯氣,轉移的電子數均為2NA
D. 5.6gFe粉與足量S粉加熱充分反應轉移的電子數為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學院科研團隊研究表明,在常溫常壓和可見光下,基于LDH(一種固體催化劑)合成NH3的原理示意圖如右。下列說法不正確的是

A. 該過程將太陽能轉化成為化學能
B. 該過程中,只涉及極性鍵的斷裂與生成
C. 氧化劑與還原劑的物質的量之比為1∶3
D. 原料氣N2可通過分離液態空氣獲得
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家預言,燃料電池將是21世紀獲得電能的重要途徑。近幾年開發的甲醇燃料電池是采用鉑作電極催化劑,電池中的質子交換膜只允許質子(就是H+)和水分子通過。其工作原理的示意圖如下,請回答下列問題:
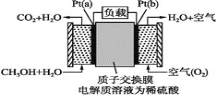
(1)該裝置的能量轉化形式為________。
(2)Pt(a)電極是電池________(填“正”或“負”)極;
(3)電解液中的H+向_____(填“a”或“b”)極移動;
(4)如果該電池工作時消耗1 mol CH3OH,則電路中通過___ mol電子。
(5)比起直接燃燒燃料產生電力,使用燃料電池有許多優點,其中主要有兩點:首先是燃料電池的能量轉化率高,其次是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com