
 C2H5OH、NaClO、H2O2、SO2等常用于殺菌消毒或抑制微生物生長.
C2H5OH、NaClO、H2O2、SO2等常用于殺菌消毒或抑制微生物生長. .
.| 熔點(℃) | 沸點(℃) | |
| SO2 | -75.5 | -10 |
| SO3 | 16.8 | 44.8 |
分析 (1)O2-有8個質子,核外有10個電子;
(2)乙醇可使蛋白質變性;
(3)陽極生成氯氣,氯氣和氫氧化鈉反應生成NaClO,陰極生成氫氣;平衡常數等于生成物濃度冪之積除以反應物濃度冪之積;
(4)過氧化物與適量稀硫酸作用并過濾,即可制得H2O2溶液,說明生成硫酸鹽沉淀,應為硫酸鋇;
(5)由圖可知2molSO2被氧氣氧化為SO3放出akJ的能量,結合1mol氣態SO3轉化為液態SO3放出b kJ熱量計算.
解答 解:(1)O2-有8個質子,核外有10個電子,則O2-的結構示意圖為 ,故答案為:
,故答案為: ;
;
(2)75%的乙醇水溶液可以使蛋白質變性,則可用于殺菌消毒,故答案為:75%的乙醇水溶液可以使蛋白質變性;
(3)陽極生成氯氣,氯氣和氫氧化鈉反應生成NaClO,陰極生成氫氣,平衡常數等于生成物濃度冪之積除以反應物濃度冪之積,K=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$,
故答案為:H2;$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$;
(4)過氧化物與適量稀硫酸作用并過濾,即可制得H2O2溶液,說明生成硫酸鹽沉淀,應為硫酸鋇,則氧化物為BaO2,反應的方程式為BaO2+H2SO4=BaSO4+H2O2,
故答案為:BaO2+H2SO4=BaSO4+H2O2;
(5)由圖可知2molSO2被氧氣氧化為SO3氣體放出akJ的能量,且1mol氣態SO3轉化為液態SO3放出b kJ熱量,則熱化學方程式為2SO2(g)+O2(g)=2SO3(l)△H=-(a+2b) kJ•mol-1,
故答案為:2SO2(g)+O2(g)=2SO3(l)△H=-(a+2b) kJ•mol-1.
點評 本題考查較為綜合,涉及C2H5OH、NaClO、H2O2、SO2等物質的性質以及應用,多角度考查學生的分析能力,題目難度適中,有利于培養學生良好的科學素養.


 名師伴你成長課時同步學練測系列答案
名師伴你成長課時同步學練測系列答案科目:高中化學 來源: 題型:選擇題
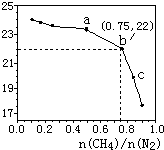 已知:在700℃的恒溫、恒容密閉容器中發生反應3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4與N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$時CH4的平衡轉化率如圖所示,下列說法正確的是( )
已知:在700℃的恒溫、恒容密閉容器中發生反應3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4與N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$時CH4的平衡轉化率如圖所示,下列說法正確的是( )| A. | n(CH4)/n(N2)越大,CH4的轉化率越高 | |
| B. | a點對應的平衡常數比c點的大 | |
| C. | b點對應的NH3的體積分數為26% | |
| D. | 不改變投料比,增加n(N2)時,NH3體積分數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 X、Y、Z、W四種短周期元素(其中只有一種是金屬元素)在周期表中的相對位置如圖所示.下列說法正確的是( )
X、Y、Z、W四種短周期元素(其中只有一種是金屬元素)在周期表中的相對位置如圖所示.下列說法正確的是( )| A. | 簡單離子的半徑:X3+>Z3- | |
| B. | 元素Z的最外層電子可能為6 | |
| C. | 元素Y的最高價氧化物的水化物可能是強酸 | |
| D. | 元素W的最高價氧化物的水化物屬于共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
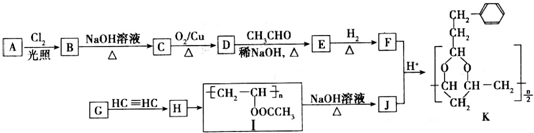
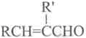 +H2O(R,R′表示烴基或氫)
+H2O(R,R′表示烴基或氫)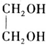 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$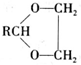 +H2O
+H2O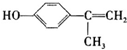 (寫結構簡式).
(寫結構簡式). .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| X | Y | |||
| Z | W | Q |
| A. | X、Y、W三種元素最低價氫化物的沸點依次升高 | |
| B. | 原子半徑:Q>W>Z>Y>X | |
| C. | 最高價氧化物對應水化物的酸性:Q>W>Z | |
| D. | X及Q的氣態氫化物相反應,形成的化合物為離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
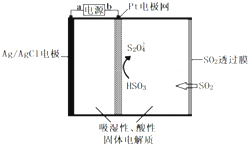
| A. | b為電源的正極 | |
| B. | 負極反應式 Ag-e-+Cl-═AgCl | |
| C. | 當電路中電子轉移為5×10-5 mol時,進入傳感器的SO2為 1.12 mL | |
| D. | 陰極的電極反應式是:2HSO3-+2H++2e-═S2O42-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 科學家最近在-100℃的低溫下合成了一種烴X,紅外光譜和核磁共振表明其分子中氫原子的化學環境沒有區別,根據分析,繪制了分子的球棍模型,如圖,下列說法中不正確的是( )
科學家最近在-100℃的低溫下合成了一種烴X,紅外光譜和核磁共振表明其分子中氫原子的化學環境沒有區別,根據分析,繪制了分子的球棍模型,如圖,下列說法中不正確的是( )| A. | 該烴X與等質量的甲烷相比,X燃燒時消耗的氧氣更多 | |
| B. | 分子中碳原子的化學環境有2種 | |
| C. | 分子中的氫原子分布在兩個互相垂直的直線上 | |
| D. | 分子中有C-C鍵,也有C=C鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com