
【題目】A、B、C、D、E、F為前四周期原子序數依次增大的六種元素,A、C、D原子均有兩個未成對電子,A、B、C同周期,A與D、B與F分別同主族,E是生活中用量最大的金屬。請回答下列問題:
(1)E比較穩定的離子核外電子排布式_____________________________.
(2)A、B、C的第一電離能由小到大的順序為_________________![]() 用元素符號表示
用元素符號表示![]() 、B、C的簡單氫化物中最易汽化的物質的化學式___________.
、B、C的簡單氫化物中最易汽化的物質的化學式___________.
(3)C與D形成的物質的晶體類型是____________,IT產業中該晶體用于生產____________.
(4)由A、B、C三種元素中的一種或兩種元素形成的分子中,有的互為等電子體,寫出其中一組等電子體的化學式:______![]() 并寫出對應的結構式_______________.
并寫出對應的結構式_______________.
(5)B的單質晶胞與![]() 的相似,則一個晶胞中含B的原子個數為____
的相似,則一個晶胞中含B的原子個數為____![]() 與氫形成的分子空間構型是_______.
與氫形成的分子空間構型是_______.
(6)“砒霜”是一種含C,F的化合物,其分子結構如圖1所示,該化合物的分子式為F4C6,F原子采取______雜化;C,D,E組成的化合物的晶胞如圖2,其晶胞參數為a pm,則其密度為___________________g/cm3(列出式子即可,阿伏伽德羅常數為NAmol-1)。

【答案】 ![]() 或
或![]()
![]()
![]() 原子晶體 光導纖維
原子晶體 光導纖維 ![]() 和CO
和CO ![]() 和
和![]() 8 三角錐形 sp3
8 三角錐形 sp3 ![]()
【解析】A、B、C、D、E、F為前四周期原子序數依次增大的六種元素,A、C、D原子均有兩個未成對電子,則A是質子數為6的C,C是質子數為8的O,D為質子數為14的Si;而A、B、C同周期,則B是N;A與D、B與F分別同主族,則F是As;E是生活中用量最大的金屬,則E為Fe。綜上所述,A為C,B為N,C為O,D為Si,E為Fe,F為As。
(1)Fe比較穩定的離子是Fe3+,其核外電子排布式為![]() 或
或![]() 。
。
(2)同周期元素隨原子序數的增大,第一電離能呈增大趨勢,但N的2p能級容納3個電子,為半充滿狀態,能量較低,其第一電離能高于O,故第一電離能由小到大的順序為:![]() ;
;![]() 、B、C的簡單氫化物中最易汽化的物質就是沸點最低的,其中H2O和NH3中均存在氫鍵,沸點較高,所以最易氣化的物質為CH4。
、B、C的簡單氫化物中最易汽化的物質就是沸點最低的,其中H2O和NH3中均存在氫鍵,沸點較高,所以最易氣化的物質為CH4。
(3)C與D形成的物質是二氧化硅,屬于原子晶體,IT產業中該晶體用于生產光導纖維。
(4)由C、N、O三種元素中的一種或兩種元素形成的分子中互為等電子體有![]() 和CO,對應的結構式
和CO,對應的結構式![]() 和
和![]() 。
。
(5)N2的晶胞與![]() 的相似,所以晶胞中氮氣分子的個數為:8
的相似,所以晶胞中氮氣分子的個數為:8![]() +6
+6![]() =4,則一個晶胞中含N的原子個數為2
=4,則一個晶胞中含N的原子個數為2![]() As與氫形成的分子為AsH3,其空間構型類似于NH3,為三角錐形。
As與氫形成的分子為AsH3,其空間構型類似于NH3,為三角錐形。
(6)氧原子能形成2個共價鍵,As形成3個共價鍵,由圖可知分子中O原子數為6,As原子數為4,所以其化學式為As4O6;As最外層有5個電子,形成3個共價鍵即![]() 鍵電子對數為3,另外還有1個孤電子對,所以As的雜化方式為sp3;在該晶胞結構中,含有O、Si、Fe,其中含Fe原子數目為8
鍵電子對數為3,另外還有1個孤電子對,所以As的雜化方式為sp3;在該晶胞結構中,含有O、Si、Fe,其中含Fe原子數目為8![]() =2,含Si
=2,含Si![]() +6
+6![]() =4,化學式為Fe2SiO4,其摩爾質量為204g/mol,晶胞的密度為
=4,化學式為Fe2SiO4,其摩爾質量為204g/mol,晶胞的密度為![]() =
=![]() =
=![]() g
g![]() cm-3,故答案為:
cm-3,故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】同分異構現象是造成有機物種類繁多的重要原因之一。下列互為同分異構體的是
A.甲烷與丙烷B.乙醇與乙酸
C.乙烯與乙烷D.CH3CH2CH2CH3與CH3CH(CH3)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現欲配制500 mL 0.040 mol·L-1的K2Cr2O7溶液。
(1)所需的儀器有:托盤天平、藥匙、燒杯、________、________、________。(在橫線上填寫所缺儀器的名稱)
(2)在溶液的配制過程中,有以下基本實驗步驟,正確的操作順序是(填寫操作步驟的代號,每個操作步驟只用一次)________。
①顛倒搖勻 ②定容 ③洗滌 ④溶解 ⑤轉移 ⑥稱量
(3)用托盤天平稱取K2Cr2O7固體的質量為________ g。
(4)下列操作使最后實驗結果偏小的是________(填序號)。
A.加水定容時俯視刻度線 B.轉移前,容量瓶中含有少量蒸餾水未干燥
C.未洗滌燒杯內壁和玻璃棒 D.搖勻后發現凹液面低于刻度線又加水補上
(5)定容時,如果不小心加水超過了刻度線,則處理的方法是________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是( )
A.在燒瓶中將熟石灰和氯化銨混合,加水調成泥狀后加熱可制得氨氣
B.為防止糧食、罐頭、水果等食品腐爛,常用氮氣做保護氣
C.SO2與過量氨水反應生成(NH4)2SO3
D.氣體NO和液體H2O能形成噴泉實驗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25 ℃時,密閉容器中X、Y、Z三種氣體的初始濃度和平衡濃度如下表:
物質 | X | Y | Z |
初始濃度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡濃度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列說法正確的是
A. 反應可表示為:X(g)+Y(g) ![]() 2Z(g)
2Z(g)
B. 反應達到平衡時,X的轉化率為60%
C. 在此條件下,該反應的平衡常數為K=1600
D. 其他條件不變時,增大壓強平衡發生移動,再達新平衡,平衡常數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水鈷礦中除SiO2外,還有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。


(1)在一定濃度的![]() 溶液中,鈷的浸出率隨時間、溫度的變化如圖1所示
溶液中,鈷的浸出率隨時間、溫度的變化如圖1所示![]() 考慮生產成本和效率,最佳的浸出時間為______小時,最佳的浸出溫度為______
考慮生產成本和效率,最佳的浸出時間為______小時,最佳的浸出溫度為______![]()
(2)請配平下列除鐵的化學方程式:____________
_ _Fe2(SO4)3+ H2O + Na2CO3 == Na2Fe6(SO4)4(OH)12↓+ Na2SO4 + CO2↑
(3) “除鈣、鎂”的原理反應為:![]() ;
;![]() 已知
已知![]() ,加入過量NaF溶液反應完全后過濾,則濾液中
,加入過量NaF溶液反應完全后過濾,則濾液中![]() ____________________.
____________________.
(4) “沉淀”中含雜質離子主要有![]() 、
、![]() 、_________和__________;“操作X”包括_________和_________。
、_________和__________;“操作X”包括_________和_________。
(5)某鋰離子電池正極是![]() ,含
,含![]() 導電固體為電解質
導電固體為電解質![]() 充電時,
充電時,![]() 還原為Li,并以原子形式嵌入電池負極材料碳
還原為Li,并以原子形式嵌入電池負極材料碳![]() 中
中![]() 如圖2所示
如圖2所示![]() 電池反應為
電池反應為![]()
![]()
![]() ,寫出該電池放電時的正極反應式 ________________________________________.
,寫出該電池放電時的正極反應式 ________________________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用0.1 mol/L的NaOH溶液分別滴定體積均為20mL、濃度均為0.1 mol/L的HCl溶液和HX溶液,溶液的pH隨加入 NaOH溶液體積的變化如圖所示。下列說法正確的是
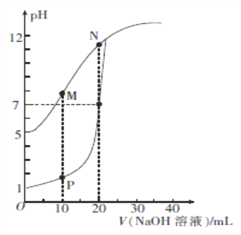
A. HX的電離平衡常數Ka約為1×10-5
B. M點對應溶液中:c(HX)< c (X-)
C. P點對應溶液中: c(Cl-)=0.05mol/L
D. N點對應溶液中:c(Na+)>c(X-)>c(OH-) >c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,某同學將鹽酸與氨水等體積混合,兩種溶液的濃度和混合后所得溶液的pH如下表:
實驗編號 | 氨水濃度/mol·L-1 | 鹽酸濃度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
請回答下列問題:
(1)①中所得混合溶液c(OH-)=______ mol·L-1。
(2)②中,c______0.2(填“>”“<”或“=”)。
(3)③中所得混合溶液,各離子濃度由大到小的順序是_______。
(4)①、③所用氨水中的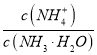 :①_______③(填“>”“<”或“=”)。
:①_______③(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列措施是為了降低化學反應速率的是( )
A.合成氨的反應中,選擇“觸媒”作催化劑
B.保存濃硝酸時,通常用棕色瓶并放在陰涼處
C.在試管中進行鋁和氫氧化鈉溶液反應時,稍微加熱
D.用純鋅與稀硫酸反應制取氫氣時,在溶液中加入少量硫酸銅溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com