
分析 (1)1molCH3OH完全燃燒生成穩定的氧化物為氣態二氧化碳和液態水,放出熱量726.51kJ/mol,以此書寫熱化學方程式;
(2)甲醇燃料電池中,甲醇為負極,電解質為酸,甲醇失去電子生成二氧化碳.
解答 解:(1)1molCH3OH完全燃燒生成穩定的氧化物為氣態二氧化碳和液態水,放出熱量726.51kJ/mol,則燃燒的熱化學方程式為CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol,
故答案為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol;
(2)甲醇燃料電池中,甲醇中C元素的化合價升高,則甲醇為負極,電解質為酸,甲醇失去電子生成二氧化碳,電極反應為CH3OH+H2O-6e-=CO2+6H+,
故答案為:CH3OH+H2O-6e-=CO2+6H+.
點評 本題為綜合題,涉及反應熱的計算、熱化學反應方程式的書寫、燃料電池等知識點,注重高考常考考點的考查,題目難度中等.


 期末100分闖關海淀考王系列答案
期末100分闖關海淀考王系列答案 小學能力測試卷系列答案
小學能力測試卷系列答案科目:高中化學 來源: 題型:解答題
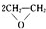
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空氣 |
| 反應條件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡轉化率 | 乙炔平衡轉化率90%左右 | 乙烯平衡轉化率80%左右 |
| 日產量 | 2.5噸(某設備條件下) | 3.6噸(相同設備條件下) |
| 原料生產工藝過程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、電爐}$CaC2$\stackrel{③飽和食鹽水}{→}$C2H2 |
| 乙烯 | 來源于石油裂解氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
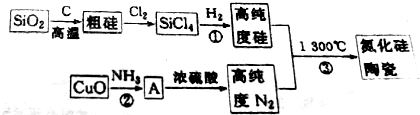
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
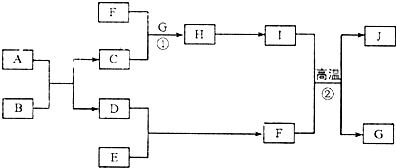
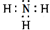 ,含有的化學鍵類型是極性共價鍵
,含有的化學鍵類型是極性共價鍵查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下22.4L任意比的氫氣和二氧化碳的混合氣體中含有的分子總數均為NA | |
| B. | 0.1mol/LNaCl溶液中Na+的數目為0.1NA | |
| C. | 標準狀況下,5.6L四氯化碳含有的分子數為0.25NA | |
| D. | 500mL0.2mol/L飽和FeCl3溶液完全轉化可制得0.1NA個Fe(OH)3膠粒 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com