
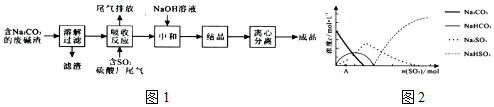
分析 利用工業廢堿渣(主要成分Na2CO3)吸收硫酸廠尾氣中的SO2制備無水Na2SO3,吸收塔中發生的反應為2CO32-+SO2+H2O=2HCO3-+SO32-,為了降低由中和器所得溶液中Na2SO3的溶解度,從而提高結晶產率,中和器中加入的NaOH是過量的,加入氫氧化鈉進入中和器得到溶液結晶進入離心機干燥得到晶體,濾液重新進入吸收塔循環使用.
(1)二氧化硫在空氣中變化生成硫酸,會導致酸雨;
(2)由圖可知,初期反應(圖中A點以前)碳酸鈉與二氧化硫反應生成碳酸氫鈉與亞硫酸鈉;
(3)隨著二氧化硫通入量增大,后期生成主要是得到亞硫酸氫鈉,中和器中主要是將亞硫酸氫鈉轉化為硫酸鈉,同時碳酸氫鈉反應得到碳酸鈉;
(4)已知Na2SO3在33℃時溶解度最大,將其飽和溶液加熱至33℃以上時析出無水Na2SO3,冷卻至33℃以下時析出Na2SO3•7H2O,則制備無水硫酸鈉應在33~100℃之間某一溫度下,蒸發結晶;
(5)亞硫酸鈉變質生成硫酸鈉,檢驗硫酸根離子即可證明亞硫酸鈉是否變質;
(6)①IO3-與SO32-發生氧化還原反應得到SO42-與I-,結合原子守恒、電荷守恒配平;
②根據離子方程式計算亞硫酸鈉的物質的量,進而計算其質量分數.
解答 解:(1)向大氣中排放SO2會導致酸雨發生,SO2氣體在空氣中經粉塵催化氧化為SO3,SO3與水反應能生成硫酸,有關反應的化學方程式為:2SO2+O2 $\frac{\underline{\;催化劑\;}}{\;}$2SO3;SO3+H2O═H2SO4,或二氧化硫與水反應生成亞硫酸,又被氧化為硫酸,則SO2形成硫酸型酸雨的反應為SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4;
故答案為:酸雨;
(2)由圖可知,初期反應(圖中A點以前)碳酸鈉與二氧化硫反應生成碳酸氫鈉與亞硫酸鈉,反應離子方程式為:2CO32-+SO2+H2O=2HCO3-+SO32-,
故答案為:2CO32-+SO2+H2O=2HCO3-+SO32-;
(3)隨著二氧化硫通入量增大,后期生成主要是得到亞硫酸氫鈉,中和器中主要是將亞硫酸氫鈉轉化為硫酸鈉,同時碳酸氫鈉反應得到碳酸鈉,主要反應化學方程式為:NaHSO3+NaOH=Na2SO3+H2O,
故答案為:NaHSO3+NaOH=Na2SO3+H2O;
(4)已知Na2SO3在33℃時溶解度最大,將其飽和溶液加熱至33℃以上時析出無水Na2SO3,冷卻至33℃以下時析出Na2SO3•7H2O,則制備無水硫酸鈉應在33~100℃之間某一溫度下,蒸發結晶;
故答案為:在33~100℃之間某一溫度下,蒸發結晶;
(5)亞硫酸鈉變質生成硫酸鈉,檢驗硫酸根離子即可證明亞硫酸鈉是否變質,用BaCl2溶液、稀鹽酸反應,有白色沉淀生成說明成品變質,若無說明未變;
故答案為:BaCl2溶液;稀鹽酸;
(6)①IO3-與SO32-發生氧化還原反應得到SO42-與I-,離子方程式為:IO3-+3SO32-=3SO42-+I-;
故答案為:IO3-+3SO32-=3SO42-+I-;
②消耗KIO3的物質的量為V×10-3L×c mol/L=cV×10-3mol,
由IO3-+3SO32-=3SO42-+I-,可知n(Na2SO3)=3n(KIO3)=3cV×10-3mol
則成品中Na2SO3的質量分數為:$\frac{126g/mol×cV×1{0}^{-3}mol}{mg}×100%$=$\frac{37.8cV}{m}%$;
故答案為:$\frac{37.8cV}{m}%$.
點評 本題以物質制備為載體,考查學生對原理的分析理解、物質的分離提純、氧化還原反應、物質含量測定、實驗方案設計、信息獲取與遷移運用等,需要學生具備扎實的基礎,題目難度中等.


 口算小狀元口算速算天天練系列答案
口算小狀元口算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
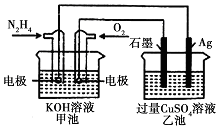
| A. | 該裝置工作時,Ag電極上有氣體生成 | |
| B. | 甲池和乙池中的溶液的pH均減小 | |
| C. | 甲池中負極反應為N2H4-4e-═N2+4H+ | |
| D. | 當甲池中消耗0.1molN2H4時,乙池中理淪上最多產生6.4g固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在濃硫酸作用下,60g冰醋酸與足量無水乙醇反應生成乙酸乙酯的分子數為NA | |
| B. | 標準狀況下,3.36LC2H4和C3H6的混合氣體中含有碳碳雙鍵的數目為0.15NA | |
| C. | 電解精煉銅,當外電路轉移NA個電子時,陽極質量減少32g | |
| D. | 含0.01molFeCl3的濃溶液滴入沸水,制得的膠體粒子數目小于0.01NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com