
 如圖所示,兩圓圈相交的陰影部分表示圓圈內的物質相互發生的反應.已知鈉及其氧化物的物質的量均為0.1mol,水的質量為100g.下列說法不正確的是( )
如圖所示,兩圓圈相交的陰影部分表示圓圈內的物質相互發生的反應.已知鈉及其氧化物的物質的量均為0.1mol,水的質量為100g.下列說法不正確的是( )| A. | Na2O2中陰陽離子數目之比為1:2 | |
| B. | 反應①的離子方程式為:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 反應③最多能產生0.05 mol O2 | |
| D. | ①、②、③充分反應后所得溶液的質量分數從大到小:①>②>③ |
分析 A.過氧化鈉中的陰離子是過氧根離子不是氧離子,根據化學式判斷陰陽離子個數之比.
B.離子方程式要遵循“原子守恒和電荷守恒等”規律.
C.根據過氧化鈉和水反應的方程式計算生成氧氣的物質的量.
D.根據固體的物質的量計算溶液中溶質的質量、溶液的質量,根據質量分數公式判斷質量分數相對大小.
解答 解:A.過氧化鈉中陰離子是O2 2-,所以陰陽離子數目之比為1:2,故A正確;
B.反應①的離子方程式為:2Na+2H2O=2Na++2OH-+H2↑,故B錯誤;
C、反應方程式為:2Na2O2+2H2O=4NaOH+O2↑,
2mol 1mol
0.1mol 0.05mol
根據方程式知,最多產生0.05mol O2,故C正確.
D、鈉、氧化鈉、過氧化鈉和水反應的方程式分別如下:
Na+H2O=NaOH+$\frac{1}{2}$H2↑,溶液增加的質量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的質量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+$\frac{1}{2}$O2↑,溶液增加的質量=m(Na2O2)-m(O2)=m(Na2O)=6.2g
所以溶液增加的質量大小順序為:鈉<氧化鈉=過氧化鈉,
根據鈉原子守恒知,0.1mol的鈉、氧化鈉、過氧化鈉、溶于水所得氫氧化鈉的物質的量分別為:0.1mol、0.2mol、0.2mol,通過以上分析可知,0.1mol的鈉、氧化鈉、過氧化鈉、分別溶于水所得溶液的質量分數分別為:$\frac{4g}{100g+2.2g}×100%$、$\frac{8g}{100g+6.2g}×100%$、$\frac{8g}{100g+6.2g}×100%$,所以①、②、③充分反應后所得溶液的質量分數從大到小:①<②=③,故D錯誤.
故選BD.
點評 本題考查了鈉及其化合物的性質,為高頻考點,側重于學生的分析能力和計算能力的考查,易錯選項是A,注意過氧化鈉中陰離子是過氧根離子不是氧離子,此為易錯點.


科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
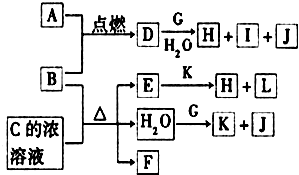 圖中,A~L為常見物質或該物質的水溶液,B在A氣體中燃燒產生棕黃色煙,B、G為中學化學中常見的金屬單質,E的稀溶液為藍色,I的焰色反應為黃色,組成J的元素原子核內只有一個質子,F為無色、有刺激性氣味的氣體,且能使品紅溶液褪色.
圖中,A~L為常見物質或該物質的水溶液,B在A氣體中燃燒產生棕黃色煙,B、G為中學化學中常見的金屬單質,E的稀溶液為藍色,I的焰色反應為黃色,組成J的元素原子核內只有一個質子,F為無色、有刺激性氣味的氣體,且能使品紅溶液褪色.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,0.5molH2中含有的H原子數 | |
| B. | 22.4升HCl氣體中含有的Cl原子 | |
| C. | 1L1mol/L硫酸溶液所含的H+數 | |
| D. | 0.1mol金屬鋁含有的電子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2和NH3 | B. | N2和O2 | C. | CO和CO2 | D. | H2S和HCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com