
| d | ||
| a | b | c |
| A. | c的簡單離子的電子層數等于其所在周期的周期序數 | |
| B. | d的氫化物的穩定性比b的氫化物強 | |
| C. | 原子半徑的大小順序是:c>b>a>d | |
| D. | 在a、b、c的最高價氧化物對應水化物中,酸性最強的是c的最高價氧化物對應水化物 |
分析 a原子最外層的電子數比次外層少3,說明A只能為15號元素磷,則b、c、d依次為硫、氯、氧,根據元素周期律的遞變規律和對應單質、化合物的性質分析.
A、c為Cl元素,其簡單離子為Cl-;
B、非金屬性越強,氫化物的穩定性越強;
C、電子層數越多,原子半徑越大;當電子層數相同時,核電荷數越大,半徑越小;
D、非金屬性越強,最高價含氧酸的酸性越強.
解答 解:A、c為Cl元素,其簡單離子為Cl-,有3個電子層,與氯元素的額周期序數相同,故A正確;
B、非金屬性越強,氫化物的穩定性越強,而同一主族從上到下,非金屬性逐漸減弱,即d的非金屬性強于b,故d的氫化物的穩定性比b的氫化物強,故B正確;
C、當比較原子半徑大小時,首先考慮電子層數,電子層數越多,原子半徑越大,故d的原子半徑最小;當電子層數相同時,核電荷數越大,半徑越小,故a、b、c的原子半徑逐漸減小,故大小順序為:a>b>c>d,故C錯誤;
D、非金屬性越強,最高價含氧酸的酸性越強,而同一周期從左到右,元素的非金屬性逐漸增強,即酸性最強的是c的最高價氧化物對應水化物,故D正確.
故選C.
點評 本題考查元素周期表與元素周期律,比較基礎,側重對元素周期律的考查,注意整體把握元素周期表的結構.


科目:高中化學 來源: 題型:解答題
| 相關信息 | |
| X | 單質為雙原子分子.若低溫蒸發液態空氣,因其沸點較低可先獲得X的單質, 該單質常溫下化學性質很穩定. |
| Y | 含Y元素的物質焰色反應為黃色 |
| Z | 同周期元素中原子半徑最小 |
| R | R元素原子的最外層電子數是K層電子數的3倍 |

 ,寫出乙溶液在空氣中變質過程的化學方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,寫出乙溶液在空氣中變質過程的化學方程式4Na2S+O2+2H2O═4NaOH+2Na2S2查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 大自然利用太陽能最成功的是植物的光合作用 | |
| B. | H2是理想的清潔燃料,儲存和運輸方便,在現實生活和生產中已大量應用 | |
| C. | 海水淡化技術的進步有助于淡水資源緊缺問題的解決 | |
| D. | 利用工業廢氣中的CO2制造全降解塑料,符合綠色環保要求 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容器內氣體A的物質的量不再隨時間而改變 | |
| B. | 容器內氣體C的濃度不再隨時間而改變 | |
| C. | 單位時間內生成amol物質A,同時生成2amol物質B | |
| D. | 單位時間內生成amol物質A,同時生成2amol物質C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 全部 | B. | ③⑤⑥ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
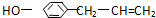 從它的結構簡式可推測它不可能有的化學性質是( )
從它的結構簡式可推測它不可能有的化學性質是( )| A. | 既可燃燒,也可使酸性KMnO4溶液褪色 | |
| B. | 可與NaHCO3溶液反應放出CO2氣體 | |
| C. | 可與FeCl3溶液發生顯色反應 | |
| D. | 既可與Br2發生加成反應又可發生取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用重結晶法可除去KNO3晶體中混有少量NaCl晶體 | |
| B. | 實驗室制取乙酸丁酯時用水浴加熱 | |
| C. | 在硫酸鋇懸濁液中加入足量飽和碳酸鈉溶液可將其轉化為碳酸鋇 | |
| D. | 二氧化硫分別通入到硫化鈉和硝酸鋇溶液中產生沉淀可證明二氧化硫的氧化性和還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com