
| m | n | ||
| x | y |
 ,(mn)2稱為擬鹵素,性質與鹵素相似,其與氫氧化鈉溶液反應的化學方程式為2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2稱為擬鹵素,性質與鹵素相似,其與氫氧化鈉溶液反應的化學方程式為2NaOH+(CN)2=NaCN+NaOCN+H2O. 分析 4種元素都是短周期元素,且為相鄰主族,根據元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期,x原子核外電子數是m的2倍,y的氧化物具有兩性,則y是Al元素,根據元素相對位置可知,x是Mg元素、m是C元素、n元素N元素,據此結合元素周期律知識進行解答.
解答 解:4元素都是短周期元素,且為相鄰主族,根據元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期,x原子核外電子數是m的2倍,y的氧化物具有兩性,則y是Al元素,根據元素位置知,x是Mg元素、m是C元素、n元素N元素,
(1)元素x是Mg元素,其原子序數為12,在周期表中的位置是第三周期第IIA族,
故答案為:三;IIA;
(2)m、n、y分別是C、N、Al,元素的金屬性越強,其最高價氧化物的水化物堿性越強,元素的非金屬性越強,其最高價氧化物的水化物酸性越強,這三種元素金屬性最強的是Al元素、非金屬性最強的是N元素,所以酸性最強的是HNO3,堿性最強的是Al(OH)3,
故答案為:HNO3;Al(OH)3;
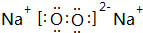
(3)氣體分子(mn)2為(CN)2,電子式為 ,根據氯氣和氫氧化鈉溶液反應知,(CN)2和NaOH反應生成NaCN、NaOCN、H2O,反應方程式為2NaOH+(CN)2=NaCN+NaOCN+H2O,
,根據氯氣和氫氧化鈉溶液反應知,(CN)2和NaOH反應生成NaCN、NaOCN、H2O,反應方程式為2NaOH+(CN)2=NaCN+NaOCN+H2O,
故答案為: ;2NaOH+(CN)2=NaCN+NaOCN+H2O.
;2NaOH+(CN)2=NaCN+NaOCN+H2O.
點評 本題考查了元素周期表和元素周期律的綜合應用,題目難度中等,根據元素在周期表中物質及元素性質確定元素,再結合物質的性質分析解答,采用知識遷移的方法分析解答(3)題.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 34S原子核內中子數為16 | |
| B. | 1H${\;}_{2}^{16}$O和1H${\;}_{2}^{18}$O的相對分子質量不同 | |
| C. | 13C和15N原子的原子序數相差2 | |
| D. | 2H+結合OH-的能力比1H+的更強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 編號 | 元素原子結構 |
| X | 原子結構示意圖為 |
| Y | 最外層電子數是次外層電子數的2倍 |
| Z | 原子核內含有12個中子,且其離子的結構示意圖為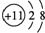 |
 ,用電子式表示X的氣態氫化物的形成過程
,用電子式表示X的氣態氫化物的形成過程 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿金屬都可以保存在煤油中 | |
| B. | 堿金屬元素的單質硬度小、密度小、熔點低 | |
| C. | 在空氣中加熱均可生成多種氧化物 | |
| D. | 堿金屬與水反應,均漂浮在水面上 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均為共價化合物 | |
| C. | 由Z、M兩種元素形成化合物的分子式一定為M2Z | |
| D. | 由 X、Y、Z、M 四種元素形成的化合物可以既有離子鍵,又有共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
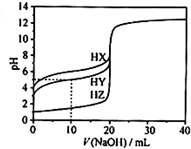 25℃時,用濃度為0.1000mol/L的NaOH溶液滴定20.00mL濃度均為0.1000mol/L的三種酸HX、HY、HZ,滴定曲線如圖所示.下列說法不正確的是( )
25℃時,用濃度為0.1000mol/L的NaOH溶液滴定20.00mL濃度均為0.1000mol/L的三種酸HX、HY、HZ,滴定曲線如圖所示.下列說法不正確的是( )| A. | 在相同溫度下,同濃度的三種酸溶液的導電能力順序:HZ>HY>HX | |
| B. | 根據滴定曲線,可得Ka(HY)≈10-5 | |
| C. | 將上述HX、HY溶液等體積混合后,用NaOH溶液滴定至HX恰好完全反應時:c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | HY與HZ混合,達到平衡時:c(H+)=$\frac{{k}_{2}(HY)•c(HY)}{c({Y}^{-})}$+c(Z-)+c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,同體積的氣體A、B質量比m:n | |
| B. | 25℃時,1Kg氣體A與1Kg氣體B的分子數之比為n:m | |
| C. | 同溫同壓下,氣體A與氣體B的密度之比為n:m | |
| D. | 標準狀況下,等質量的A與B的體積比為n:m |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
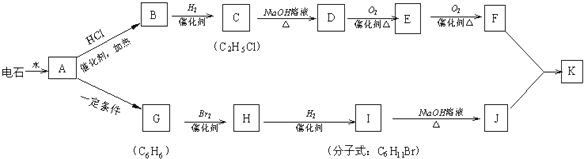
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr; .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com