
已知A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數A<B<C<D<E。其中A、B、C是同一周期的非金屬元素。化合物DC為離子化合物,D的二價陽離子與C的陰離子具有相同的電子層結構。AC2為非極性分子,是產生溫室效應的主要氣體。B、C的氫化物的沸點比它們同族相鄰周期元素氫化物的沸點高。人體缺E元素會得軟骨病,D與E位于同主族。請根據以上情況,回答下列問題:(答題時,A、B、C、D、E用所對應的元素符號表示)
(1)A、B、C非金屬性由強到弱的順序為________。
(2)B的氫化物的分子式是________,B的氫化物溶于水的電離方程式為
________________________________________________________________________。
(3)寫出化合物AC2的電子式:________,它是________(填“極性”或“非極性”)鍵形成的非極性分子。
(4)B的最高價氧化物對應的水化物的稀溶液與D的單質反應時,B被還原到最低價,該反應的化學方程式是_________________________________________________。
科目:高中化學 來源:2017屆貴州省貴陽市高三下學期第六次適應性考試理綜化學試卷(解析版) 題型:選擇題
下列說法不正確的是
A. 有機物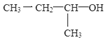 的名稱為2-丁醇
的名稱為2-丁醇
B. 蛋白質、淀粉、纖維素都是高分子化合物
C. 合成有機物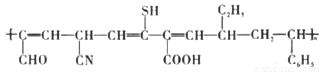 使用的單體有3種
使用的單體有3種
D. 等質量的乙烯和乙醇完全燃燒消耗氧氣的量相同
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二3月月考化學試卷(解析版) 題型:填空題
(1)丙烯腈可用“丙烯氨氧化法”生產,生成丙烯腈的熱化學方程式為:
CH2=CHCH3(g)+NH3(g)+3/2O2(g)= CH2=CHCN (g)+3H2O(g) △H=-515kJ/mol。該法在生產中有多種副產物生成,其中丙烯醛是主要副產物之一。若氣態丙烯與氧氣反應生成22.4g氣態丙烯醛和水蒸汽,同時放出141.2kJ熱量,則反應的熱化學方程式為:______,該反應在任何溫度下都能自發進行,其原因是______。
(2)圖(a)為在某一時間段一密閉體系中生成丙烯腈的反應速率與反應進程的曲線關系。由圖可知,t1時刻表示體系改變的反應條件為______;t2時刻表示體系改變的另一反應條件為______,此時平衡______移動(填“正向”、“逆向”或“不”)。

(3)圖(b)為丙烯腈產率與反應溫度的關系曲線,最高產率對應的溫度為460℃ 。在相同的反應時間內,高于460℃時丙烯腈產率降低的可能原因是______(填序號)。
A.平衡常數變大
B.平衡常數變小
C.副反應增多
D.反應活化能增大
在相同的反應時間內.低于460℃時丙烯腈的產率______(填“是”或“不是”)對應溫度下的平衡轉化率,判斷理由是_________。
查看答案和解析>>
科目:高中化學 來源:2017屆天津市高三下學期第一次月考化學試卷(解析版) 題型:填空題
汽車尾氣中的主要污染物是NO和CO。為減輕大氣污染,人們提出通過以下反應來處理汽車尾氣:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (條件為使用催化劑)
2CO2(g)+N2(g) △H=-746.5KJ/mol (條件為使用催化劑)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
則 N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容積不變的密閉容器中,通入一定量的NO和CO,用氣體傳感器測得不同時間NO和CO的濃度如下表
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
則C2合理的數值為 (填字母標號)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等質量催化劑時,增大催化劑的比表面積可提高化學反應速率。根據下表設計的實驗測得混合氣體中NO的濃度隨時間t變化的趨勢如下圖所示:

則曲線II對應的實驗編號為 。
(4)將不同物質的量的H2O(g)和CO(g)分別通入體積為2L的恒容密閉容器中,進行反應:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三組數據:
CO2(g)+H2(g),得到如下三組數據:
實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
①實驗組i中以v(CO2)表示的反應速率為 ,溫度升高時平衡常數會 (填“增大”、“減小”或“不變”)。
②若a=2,b=1,則c= ,達平衡時實驗組ii中H2O(g)和實驗組iii中CO的轉化率的關系為αii (H2O) αiii (CO)(填“<”、“>”或“=”)。
(5)CO分析儀的傳感器可測定汽車尾氣是否符合排放標準,該分析儀的工作原理類似于燃料電池,其中電解質是氧化釔(Y2O3)和氧化鋯(ZrO2)晶體,能傳導O2-。
①則負極的電極反應式為________________。

②以上述電池為電源,通過導線連接成圖一。若X、Y為石墨,a為2L 0.1mol/L KCl溶液,寫出電解總反應的離子方程式 。電解一段時間后,取25mL上述電解后的溶液,滴加0.4mol/L醋酸得到圖二曲線(不考慮能量損失和氣體溶于水,溶液體積變化忽略不計)。根據圖二計算,上述電解過程中消耗一氧化碳的質量為__________g。
查看答案和解析>>
科目:高中化學 來源:2017屆天津市高三下學期第一次月考化學試卷(解析版) 題型:選擇題
下列實驗方案中,不能達到實驗目的的是
選項 | 實驗目的 | 實驗方案 |
A | 檢驗CH3CH2Br在NaOH溶液中是否發生水解 | 將CH3CH2Br與NaOH溶液共熱。冷卻后,取出上層水溶液,用稀HNO3酸化,加入AgNO3溶液,觀察是否產生淡黃色沉淀 |
B | 檢驗Fe(NO3)2晶體是否已氧化變質 | 將Fe(NO3)2樣品溶于稀H2SO4后,滴加KSCN溶液,觀察溶液是否變紅 |
C | 驗證Br2的氧化性強于I2 | 將少量溴水加入KI溶液中,再加入CCl4,振蕩,靜置,可觀察到下層液體呈紫色 |
D | 驗證AgI的溶解度小于AgCl | 將NaI濃溶液加入AgCl懸濁液中,振蕩,可觀察到沉淀由白色變為黃色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一3月月考化學試卷(解析版) 題型:選擇題
下列關于原子結構、元素性質的說法正確的是 ( )
A. 非金屬元素組成的化合物中只含共價鍵
B. ⅠA族金屬元素是同周期中金屬性最強的元素
C. 同種元素的原子均有相同的質子數和中子數
D. ⅦA族元素的陰離子還原性越強,其最高價氧化物對應水化物的酸性越強
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一3月月考化學試卷(解析版) 題型:選擇題
第ⅤA族元素中的A、B兩種元素所在周期分別最多可排18和8種元素,且B在A的上一周期,當A的原子序數為x時,B的原子序數為( )
A. x-8 B. x-18 C. x+8 D. x+18
查看答案和解析>>
科目:高中化學 來源:海南省、文昌中學2017屆高三下學期聯考化學試卷 題型:選擇題
己知重鉻酸鉀在水溶液中存在如下平衡:2CrO42-(黃色)+2H+ Cr2O72-(橙紅色)+H2O。下列說法正確的是
Cr2O72-(橙紅色)+H2O。下列說法正確的是
A. 當溶液的pH降低時,平衡向左移動
B. 恒溫下,將上述溶液用蒸餾水稀釋到原體積的2倍,平衡向右移動
C. 當溶液顏色不變時,溶液的c(H+)/c(OH-)是一個定值
D. 增大CrO42-濃度,平衡向右移動,平衡常數增大
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省菏澤市高一3月月考化學試卷(解析版) 題型:選擇題
一些科學家預言,存在穩定的超重元素,如:Z=114,N=184的原子,它位于元素周期表的第7周期,第ⅣA族,下列說法正確的是 ( )
A. 第七周期有50種元素 B. 該原子的質量數為184
C. 該元素的相對原子質量為292 D. 該原子核外有114個電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com