
下列各種情況下,常溫下溶液中一定能大量存在的離子組是
A.由水電離出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、Cl-、NO3-
B.無色溶液中可能大量存在 : Al3+、NH4+、Cl﹣、S2﹣
C.pH=7的中性溶液中:Fe3+、K+、Cl-、SO42-
D.酸性溶液中可能大量存在 : Na+、ClO﹣、SO42﹣、CN﹣
科目:高中化學 來源:2015-2016學年河北省高二上學期第一次月考化學試卷(解析版) 題型:選擇題
下列對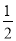 H2(g)+
H2(g)+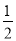 I2(g)===HI(g)ΔH=+26 kJ·mol-1的敘述中,正確的是
I2(g)===HI(g)ΔH=+26 kJ·mol-1的敘述中,正確的是
A.1 mol氫氣和1 mol碘蒸氣完全反應需要吸收26 kJ的熱量
B.1個氫分子和1個碘分子完全反應需要吸收52 kJ的熱量
C.1 mol H2(g)與1 mol I2(g)完全反應生成2 mol的HI氣體需吸收52 kJ的熱量
D.1 mol H2(g)與1 mol I2(g)完全反應放出26 kJ的熱量
查看答案和解析>>
科目:高中化學 來源:2016屆四川省高三9月月考化學試卷(解析版) 題型:選擇題
將足量的CO2不斷通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物質的量與所通入CO2的體積關系如圖所示.下列關于整個反應過程中的敘述不正確的是
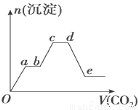
A.Oa段反應的化學方程式是Ba(OH)2+CO2═BaCO3↓+H2O
B.ab段與cd段所發生的反應相同
C.de段沉淀減少是由于BaCO3固體消失
D.bc段反應的離子方程式是2AlO2﹣+3H2O+CO2═2Al(OH)3↓+CO32﹣
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省高三上學期入學考試化學試卷(解析版) 題型:選擇題
海水開發利用的部分過程如圖所示。下列說法錯誤的是

A.向苦鹵中通入Cl2是為了提取溴
B.粗鹽可采用除雜和重結晶等過程提純
C.工業生產中常選用N aOH作為沉淀劑
aOH作為沉淀劑
D.富集溴一般先用空氣和水蒸氣吹出單質溴,再用SO2將其還原吸收
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省遵義市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下列是某學生提供的實驗數據及操作,以下組合中,完全正確的是
①配制480mL0.1mol/L氫氧化鈉溶液用500mL的容量瓶;②用托盤天平稱取5.85gNaCl固體;③中和滴定操作時,消耗0.1000mol/L的鹽酸 23.0mL;④用廣泛pH試紙測得血液的pH=7.4;⑤實驗室用乙醇制乙烯時,為更好控制溫度選擇水浴加熱法
A.只有①正確 B.只有②錯誤
C.①③④正確 D.①②③④⑤全錯
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省高二上化學試卷(解析版) 題型:選擇題
某鋰電池的電池總反應為4Li+2SOCl2=4LiCl+S+SO2,下列有關說法正確的是
A.鋰電極作電池負極,放電過程中發生還原反應
B.1 mol SOCl2發生電極反應轉移的電子數為4 mol
C.電池的正極反應為2SOCl2+2e-=4Cl-+S+SO2
D.組裝該電池必須在無水、無氧的條件下進行
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧葫蘆島一中高二上期初考試化學試卷 (解析版) 題型:選擇題
NA表示阿伏加德羅常數,下列說法正確的是
A.2.7 g鋁與足量的NaOH溶液反應,轉移的電子總數為NA
B.1 mol Al分別放入足量的冷的濃HNO3、稀HNO3中,反應后轉移的電子均為3NA個
C.各5.6 g鐵分別與足量的鹽酸、氯氣反應,電子轉移總數均為0.3NA
D.1 mol Na與足量O2反應生成Na2O或Na2O2均失去NA個電子
查看答案和解析>>
科目:高中化學 來源:2016屆四川省高三上學期第一次月考化學試卷(解析版) 題型:填空題
(14分)氮和硫的化合物對大氣都有嚴重污染,據所學化學反應原理回答下列問題:
(1)NO2與懸浮在大氣中海鹽粒子的相互作用時發生反應:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ∆H = a KJ/mol
NaNO3(s)+ClNO(g) ∆H = a KJ/mol
則該反應為 反應(填放熱或吸熱),產物ClNO的結構式為 。
(2)實驗室可用NaOH溶液吸收NO2,反應為2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液與0.2mol NO2恰好完全反應得1L溶液A,溶液B為0.1mol/L的CH3COONa溶液,則兩溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的順序為 (已知HNO2的電離常數Ka=7.1×10-4mol/L,CH3COOH的電離常數K a=1.7×10-5mol/L,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加適量水 b.向溶液A中加適量NaOH
c.向溶液B中加適量水 d.向溶液B中加適量NaOH
(3)若將SO2,NO2,O2按4:4:3通入水中充分反應,寫出總的離子方程式 。
(4)向氨水中通入過量的H2S,所得溶液M中溶質的電子式為 ;取0.2mol/L的NaOH溶液與0.1mol/L的M溶液等體積混合,加熱至充分反應后,待恢復至室溫,剩余溶液中離子濃度由大到小的順序是 ,此時測得溶液的pH=12,則此條件下M溶液中陰離子的電離平衡常數Ka= (提示:若涉及多元弱酸的電離或多元弱酸根離子的水解,均只考慮第一步電離或水解)
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省太原市高一上入學考試化學試卷(解析版) 題型:選擇題
除去下列物質中的少量雜質,所用方法正確的是( )
選項 | 物質(括號內為雜質) | 除去雜質的方法 |
A | KCl(MnO2) | 加水溶解,過濾,洗滌,干燥 |
B | FeSO4溶液(CuSO4) | 加入適量的鋅粉,過濾 |
C | NaCl溶液(CuCl2) | 加入過量的NaOH溶液,過濾 |
D | O2(H2O) | 將混合氣體通過盛有足量濃硫酸的洗氣瓶 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com