
| A. | 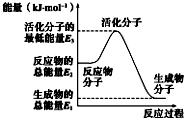 反應②中的能量變化如圖所示,則△H2=E1-E3 | |
| B. | N2的燃燒熱為180kJ•mol-1 | |
| C. | 由反應②知在溫度一定的條件下,在一恒容密閉容器中通入1 mol N2和 3 mol H2,反應后放出的熱量為Q1 kJ,若通入2 mol N2和 6 mol H2反應后放出的熱量為Q2 kJ,則184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反應為 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
分析 A、反應熱等于生成物的總能量-反應物的總能量;
B、燃燒熱是1mol可燃物完全燃燒是穩定氧化物放出的熱量,氮氣和氧氣生成的一氧化氮不是穩定氧化物,會和氧氣反應生成二氧化氮;
C、合成氨的反應為可逆反應,壓強增大平衡向正反應方向移動,92.4kJ•mol-1為生成2mol氨氣時放出的熱量;
D、由已知熱化學方程式根據蓋斯定律構造目標熱化學方程式.
解答 解:A、反應熱等于生成物的總能量-反應物的總能量,因此△H2=E1-E2,故A錯誤;
B、燃燒熱是1mol可燃物完全燃燒是穩定氧化物放出的熱量,氮氣和氧氣生成的一氧化氮不是穩定氧化物,會和氧氣反應生成二氧化氮,N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1不符合燃燒熱概念,故B錯誤;
C、合成氨的反應為可逆反應,壓強增大平衡向正反應方向移動,因此Q2>2Q1,92.4kJ•mol-1為生成2mol氨氣時放出的熱量,可逆反應不能進行到底,因此92.4×2>Q2,則184.8>Q2>2Q1,故C正確;
D、已知:①N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由蓋斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906kJ/mol,故D錯誤;
故選C.
點評 本題考查反應熱和焓變的計算以及化學平衡移動對反應熱的影響,難度中等,其中C為本題的難點,綜合性較強.


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | =196.64kJ | B. | =98.32kJ | C. | <196.64kJ | D. | >196.64kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
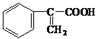 )和甲醇反應制得.
)和甲醇反應制得.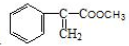
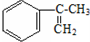 經過四步不同類型的反應制得阿托酸.
經過四步不同類型的反應制得阿托酸.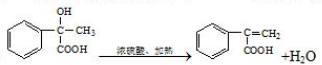 .
.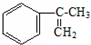 多兩個碳原子的一種同系物,且A的所有碳原子可以處于同一平面上.寫出A的結構簡式
多兩個碳原子的一種同系物,且A的所有碳原子可以處于同一平面上.寫出A的結構簡式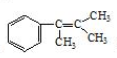 .
.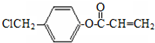 是阿托酸甲酯的某種同分異構體的一氯代物,其與足量氫氧化鈉溶液共熱,生成的有機產物的結構簡式為
是阿托酸甲酯的某種同分異構體的一氯代物,其與足量氫氧化鈉溶液共熱,生成的有機產物的結構簡式為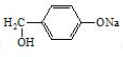 、
、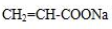 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 第一次 | 第二次 | 第三次 |
| 滴定前讀數(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后讀數(mL) | 20.12 | 20.34 | 22.12 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com