
 實驗室可以利用如圖所示裝置制備氯氣.
實驗室可以利用如圖所示裝置制備氯氣.分析 (1)二氧化錳與濃鹽酸在加熱條件下生成氯氣、氯化錳和水;氣體轉化為物質的量,根據中反應化合價的變化判斷被氧化的HCl的物質的量;
(2)濃鹽酸具有揮發性,加熱促進鹽酸的揮發,制取的氯氣中含有氯化氫和水蒸氣,應進行除雜,依據氯氣、水蒸氣的性質解答;
解答 解:(1)二氧化錳與濃鹽酸在加熱條件下生成氯氣、氯化錳和水,離子方程式:MnO2+4HCI(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCI2+2H2O+CI2↑;反應生成1mol氯氣,消耗4mol氯化氫,只有2mol被氧化,
制取2.24L標準狀況下的氯氣,氯氣的物質的量為$\frac{2.24L}{22.4L/mol}$=0.1mol,被氧化的氯化氫為0.2mol;
故答案為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCI2+2H2O+Cl2↑;0.2;
(2)氯氣中含有氯化氫和水蒸氣雜質,氯氣在飽和食鹽水中溶解度較小,氯化氫易溶于水,濃硫酸具有吸水性,能夠干燥氯氣,所以依次通過盛有飽和食鹽水、濃硫酸洗氣瓶分別除去氯化氫和水蒸氣,
故答案為:飽和食鹽水;濃硫酸.
點評 本題考查了氯氣的實驗室制備、凈化,熟悉氯氣制備原理是解題關鍵,注意氯氣凈化時氯化氫、水蒸氣除雜的先后順序,題目難度不大.


科目:高中化學 來源: 題型:解答題
| 反應物 | 起始溫度/℃ | 終了溫度/℃ | 中和熱/kJ•mol-1 | |
| 硫酸 | 堿溶液 | |||
| ①0.5 mol•L-1 H2SO4溶液50 mL、1.0 mol•L-1 NaOH溶液50 mL | 25.1 | 25.1 | △H1 | |
| ②0.5 mol•L-1 H2SO4溶液50 mL、1.1mol•L-1 NH3•H2O溶液50 mL | 25.1 | 25.1 | △H2 | |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素周期律的實質是元素原子的核外電子排布呈周期性變化 | |
| B. | 利用元素周期律可以預測元素及其化合物的性質 | |
| C. | 元素周期表有7個橫行,也就是7個周期 | |
| D. | 元素周期表有18個縱列,也就是18個族 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO3、O2 | B. | 只有O2 | C. | SO2、SO3和O2 | D. | SO2和SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2C═CH2+H2$\stackrel{催化劑}{→}$H3C-CH3 | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu/△}{→}$2CH3CHO+2H2O | |
| C. | 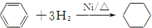 | |
| D. | 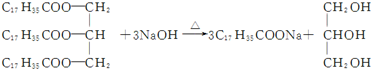 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
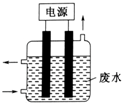 用如圖所示裝置除去含CN-、Cl-廢水中的CN-時,控制溶液pH為9~10,某電極上產生的ClO-將CN-氧化為兩種無污染的氣體,下列說法正確的是( )
用如圖所示裝置除去含CN-、Cl-廢水中的CN-時,控制溶液pH為9~10,某電極上產生的ClO-將CN-氧化為兩種無污染的氣體,下列說法正確的是( )| A. | 可以用石墨作陽極,作鐵陰極 | |
| B. | 除去CN-的反應:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 陰極的電極反應式為:Cl-+2OH-+2e-═ClO-+H2O | |
| D. | 陽極的電極反應式為:2CN-+12OH--10e-═N2↑+2CO32-+6H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
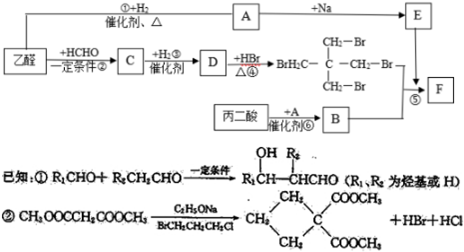
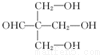 .
. .
.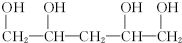 .
.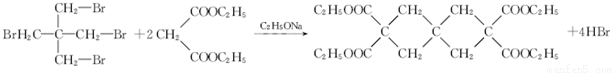 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com