
分析 A原子最外層p能級的電子數等于次外層的電子數總數,p能級電子數不超過6,則A的核外電子排布為1s22s22p2,故A為碳元素;A、B、C屬于同一周期,即位于第二周期,B原子最外層中有兩個不成對的電子,核外電子排布式為1s22s22p4,故B為O元素,B元素可分別與A、C、D、E生成RB2型化合物,則C為N元素,可形成NO2化合物;在DB2中D與B的質量比為7:8,則有M(D):2M(O)=7:8,則M(D)=28,故D為Si元素;在EB2中E與B的質量比為1:1,則M(E)=2M(O)=2×16=32,所以E為S元素,據此解答.
解答 解:A原子最外層p能級的電子數等于次外層的電子數總數,p能級電子數不超過6,則A的核外電子排布為1s22s22p2,故A為碳元素;A、B、C屬于同一周期,即位于第二周期,B原子最外層中有兩個不成對的電子,核外電子排布式為1s22s22p4,故B為O元素,B元素可分別與A、C、D、E生成RB2型化合物,則C為N元素,可形成NO2化合物;在DB2中D與B的質量比為7:8,則有M(D):2M(O)=7:8,則M(D)=28,故D為Si元素;在EB2中E與B的質量比為1:1,則M(E)=2M(O)=2×16=32,所以E為S元素.
(1)D為Si元素,原子序數為14,基態原子的核外電子排布式為1s22s22p63s23p2,
故答案為:1s22s22p63s23p2;
(2)A(碳)、B(氧)、C(氮)能夠形成的等電子體:CO、N2、CN-等,
故答案為:CO、N2、CN-;
(3)C的氫化物為NH3,N原子孤電子對數為$\frac{5-1×3}{2}$=1,價層電子對數為3+1=4,空間結構為三角錐形,N原子的雜化軌道類型為sp3雜化,
故答案為:三角錐形;sp3;
(4)C為N元素,形成的單質為N≡N,含有2個π鍵,由于O的非金屬性大于Si,則穩定性:H2O>SiH4,
故答案為:2;H2O;SiH4.
點評 本題是對物質結構的考查,涉及核外電子排布、價層電子對互斥理論、雜化方式判斷、化學鍵等,推斷元素是解題關鍵,注意理解掌握同周期第一電離能異常原因.


科目:高中化學 來源: 題型:選擇題
| A. | 用濕潤的pH試紙測稀堿液的pH值,測定值偏小 | |
| B. | 用容量瓶配制溶液,定容時仰視刻度線,所配溶液濃度偏大 | |
| C. | 用鹽酸標準溶液滴定未知濃度的NaOH溶液時,若滴定前滴定管內無氣泡,終點讀數時有氣泡,則所測NaOH溶液的濃度偏大 | |
| D. | 測定中和反應的反應熱時,將堿緩慢倒入酸中,所測溫度值偏高 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
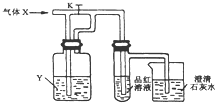
| A. | X是SO2,Y是飽和NaHCO3 溶液 | B. | X是H2S,Y是濃H2SO4 | ||
| C. | X是CO2,Y是Na2SO3 溶液 | D. | X是Cl2,Y是Na2CO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
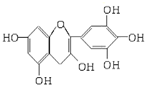 茶是我國的傳統飲品,茶葉中含有的茶多酚可以替代食品添加劑中對人體有害的合成抗氧化劑,用于多種食品保鮮等,如圖所示是茶多酚中含量最高的一種兒茶素A的結構簡式,關于這種兒茶素A的有關敘述正確的是( )
茶是我國的傳統飲品,茶葉中含有的茶多酚可以替代食品添加劑中對人體有害的合成抗氧化劑,用于多種食品保鮮等,如圖所示是茶多酚中含量最高的一種兒茶素A的結構簡式,關于這種兒茶素A的有關敘述正確的是( )| A. | ②④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Sn2+、Fe2+、Ce3+ | B. | Fe2+、Ce3+、Sn2+ | C. | Fe2+、Sn2+、Ce3+ | D. | Ce3+、Fe2+、Sn2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl-、K+、HCO3-、Ca2+ | B. | OH-、NH4+、Mg2+、HCO3- | ||
| C. | SO32-、H+、Cl-、NO3- | D. | Na+、SiO32-、H+、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入Al能放出H2的溶液中:K+、Na+、CO32-、NO3- | |
| B. | 滴入甲基橙變黃的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 能使碘化鉀淀粉試紙變藍的溶液中:Na+、NH4+、S2-、Br- | |
| D. | 水電離出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、Mg2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com