
【題目】以甲苯為主要原料,采用以下路線合成化妝品防霉劑:對![]() 羥基苯甲酸乙酯。
羥基苯甲酸乙酯。
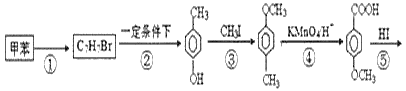
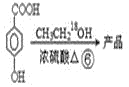
請回答:
(1)有機物C7H7Br的名稱為___。
(2)產品的摩爾質量為___。
(3)在①~⑥的反應中屬于取代反應的有___。
(4)![]() 在一定條件下發生聚合反應生成高分子化合物,寫出該反應的化學方程式(有機物寫結構簡式)___。
在一定條件下發生聚合反應生成高分子化合物,寫出該反應的化學方程式(有機物寫結構簡式)___。
(5)![]() 的同分異構體很多,其中符合下列條件有___種。
的同分異構體很多,其中符合下列條件有___種。
①遇到FeCl3溶液出現顯色現象;②能發生水解反應;③能發生銀境反應;④無-CH3結構。上述同分異構體中核磁共振氫譜顯示其有5種峰的結構簡式為___。
【答案】3-溴甲苯或對溴甲苯 168g/mol ①②③⑤⑥  +(n-1)H2O或
+(n-1)H2O或 +nH2O 3
+nH2O 3 ![]()
【解析】
甲苯發生反應生成B,B反應生成對甲基苯酚,根據甲苯和對甲基苯酚結構簡式及B的分子式知,甲苯與溴發生甲基對位取代反應生成![]() ,在一定條件下發生水解反應生成
,在一定條件下發生水解反應生成![]() ,③的反應為取代反應,④為氧化反應、⑤為取代反應、⑥發生酯化反應生成產品,則產品的結構簡式
,③的反應為取代反應,④為氧化反應、⑤為取代反應、⑥發生酯化反應生成產品,則產品的結構簡式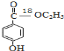 。
。
(1)由反應②的產物可判斷C7H7Br分子中,溴原子的位置在甲基的對位,名稱是3-溴甲苯或對溴甲苯;
(2)通過以上分析知,產物的結構簡式為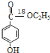 ,其摩爾質量為168g/mol;
,其摩爾質量為168g/mol;
(3)在①~⑥的反應中只有④是氧化反應,其余反應從反應前后的產物判斷都是取代反應,故答案為:①②③⑤⑥;
(4)![]() 中含有羧基、羥基,發生縮聚反應生成
中含有羧基、羥基,發生縮聚反應生成![]() ,反應方程式為n
,反應方程式為n![]()
![]()
![]() +(n-1)H2O;或n
+(n-1)H2O;或n![]()
![]()
![]() +nH2O;
+nH2O;
(5)①遇到FeCl3溶液出現顯色現象,說明分子中存在酚羥基;②能發生水解反應,說明分子中含有酯基,③能發生銀境反應,說明存在醛基,④分子無-CH3結構,因此是甲酸某酯結構,苯環上有兩個取代基,所以符合以上條件![]() 的同分異構體有鄰、間、對3種,有5種氫原子的只能是對位結構,結構簡式為
的同分異構體有鄰、間、對3種,有5種氫原子的只能是對位結構,結構簡式為![]() 。
。


科目:高中化學 來源: 題型:
【題目】請把下列現象中濃硫酸表現出來的性質寫填在對應的空白處:
(1)把濃硫酸滴在白紙上,白紙變黑,則濃硫酸表現___(填“脫水性”或“氧化性”);
(2)盛有濃硫酸的燒杯敞口放置一段時間,質量增加,則濃硫酸表現出___(填“吸水性”或“脫水性”);
(3)濃硫酸與碳共熱時發生反應2H2SO4(濃)+C![]() CO2↑+2SO2↑+2H2O,在該反應中,濃硫酸表現出___(填“酸性”或“強氧化性”)。
CO2↑+2SO2↑+2H2O,在該反應中,濃硫酸表現出___(填“酸性”或“強氧化性”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸乙酯是一種用途廣泛的精細化工產品。工業生產乙酸乙酯的方法很多,如圖:

下列說法正確的是
A. 反應①、②均是取代反應
B. 反應③、④的原子利用率均為100%
C. 與乙酸乙酯互為同分異構體的酯類化合物有2種
D. 乙醇、乙酸、乙酸乙酯三種無色液體可用Na2CO3溶液鑒別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A(C2H2)是基本有機化工原料。由A制備高分子降解塑料(PVB)和IR的合成路線(部分反應條件略去)如圖所示:
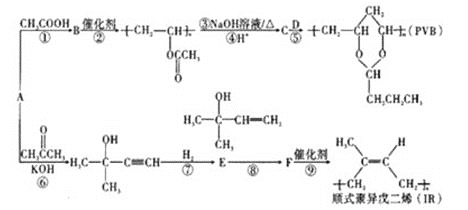
已知:①RCHO+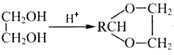 +H2O;
+H2O;
②RBr![]() RCOOH。
RCOOH。
試回答下列問題:
(1)過程①的反應類型為___,B中含氧官能團的名稱是___。
(2)反應⑧的化學方程式為___。反應③的化學方程式為___。
(3)關于過程②,下列說法正確的是___(填序號)。
a.反應②屬于縮聚反應
b.生成的高分子化合物還能與溴水反應而使其褪色
c.該高分子鏈節具有和其單體完全一樣的結構
d.生成的高分子材料具有熱塑性,且為混合物
e.通過質譜儀測得該高分子的平均相對分子質量為30444,可推知其n約為354
(4)F分子中最多有___個原子共平面,D的結構簡式是___。
(5)G與E互為同分異構體,則G的所有同分異構體中含有碳碳雙鍵的結構(包含E在內且不考慮順反異構)共有___種。(已知碳碳雙鍵與羥基直接相連不穩定,不考慮)
(6)利用題目信息,以乙烯為起始原料,選用必要的無機試劑合成丁二酸乙二酯,寫出合成路線___(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸橙花酯是一種食用香料,其結構簡式如圖,關于該有機物的敘述中正確的是( )
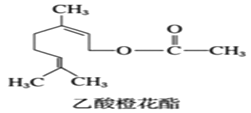
①分子式為C12H19O2;②不能發生銀鏡反應;③mol該有機物最多能與3mol氫氣發生加成反應;④它的同分異構體中不可能有酚類;⑤1mol該有機物與NaOH溶液反應最多消耗1molNaOH;⑥屬于芳香族化合物。
A.②④⑤B.①④⑤C.②③⑥D.②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學用語在化學學科中作用非常重要,以下有關化學用語描述正確的是( )
A.Mg2+的電子排布式:1s22s22p63s2
B.氨氣的空間結構:三角形
C.Na2S的電子式:![]()
D.甲醛的結構簡式:CH2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A是日常生活中最常見的金屬,其轉化關系如圖(部分反應物或生成物已略去)。
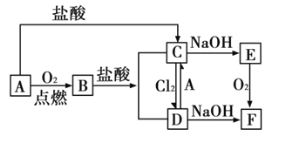
(1)寫出![]() 的化學式_____________;溶液
的化學式_____________;溶液![]() 的顏色是______________。
的顏色是______________。
(2)寫出下列轉化的離子方程式:
①![]() :_________________。
:_________________。
②![]() :__________________。
:__________________。
(3)![]() 轉化為
轉化為![]() 過程中,可觀察到白色沉淀迅速變成灰綠色,最后變成紅褐色,該反應的化學方程式為:________________。
過程中,可觀察到白色沉淀迅速變成灰綠色,最后變成紅褐色,該反應的化學方程式為:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以前實驗室制備純堿(Na2CO3)的主要步驟為:將飽和NaCl溶液倒入燒杯加熱,控制30—35℃,攪拌下分批加入研細的NH4HCO3固體,加料完畢,保溫30分鐘,靜置、過濾得NaHCO3晶體。用少量蒸餾水洗滌除去雜質、抽干,轉入蒸發皿中灼燒得Na2CO3固體。四種鹽在不同溫度下的溶解度表 (g/100g水)
溫度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | — | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反應控制在30—35℃,是因為高于35℃NH4HCO3會分解,低于30℃則反應速率降低 ,為控制此溫度范圍,通常采取的加熱方法為________________;
②加料完畢,保溫30分鐘,目的_________;
③過濾所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入適當試劑并作進一步處理,使_________________(填化學式)循環使用,回收得到NH4Cl晶體。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物①在一定條件下可以制備②,下列說法錯誤的是
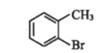 ①→
①→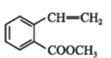 ②
②
A.①不易溶于水
B.①的芳香族同分異構體有3種(不包括①)
C.②在堿性條件下的水解是我們常說的皂化反應
D.②中所有碳原子可能共平面
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com