
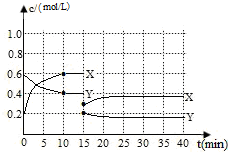
 已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.現將一定量NO2和N2O4的混合氣體通入體積為1L的恒溫密閉容器中發生上述反應,反應物濃度隨時間變化關系如下圖所示.X與Y兩條曲線中,Y表示N2O4濃度隨時間的變化
已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.現將一定量NO2和N2O4的混合氣體通入體積為1L的恒溫密閉容器中發生上述反應,反應物濃度隨時間變化關系如下圖所示.X與Y兩條曲線中,Y表示N2O4濃度隨時間的變化分析 (1)由圖象可知達到10min時X的物質的量濃度變化為0.2,Y變化為0.1.則X為NO2,Y為N2O4,發生N2O4(g)?2NO2(g)△H>0,結合平衡濃度計算;
(2)達到平衡狀態時,正逆反應速率相等,各物質的濃度不變,含量不變;
(3)反應進行至15min時,反應物和生成物濃度都減少,說明容器體積增大
(4)化學平衡常數只與溫度有關.
解答 解:(1)根據圖象中物質濃度變化知,反應物是四氧化二氮、生成物是二氧化氮,v(NO2)=$\frac{0.6mol/L-0.2mol/L}{10min}$=0.04mol/(L•min),
由圖象可知達到10min時X的物質的量濃度變化為0.2,Y變化為0.1.則X為NO2,Y為N2O4,發生N2O4(g)?2NO2(g)△H>0,
平衡時c(NO2)=0.8mol/L,c(N2O4)=0.6mol/L,平衡常數K=$\frac{0.{8}^{2}}{0.6}$=1.1,
故答案為:0.04;1.1;
(2)A.體系的顏色不再改變,說明濃度不變,可說明達到平衡狀態,故A正確;
B.反應前后體積不等,混合氣體的壓強不再改變,可說明達到平衡狀態,故B正確;
C.因體積、質量不變,則混合氣體的密度不再改變不能說明達到平衡狀態,故C錯誤;
D.2v (NO2)=v(N2O4),不能說明正逆反應速率相等,故D錯誤.
故答案為:A B;
(3)反應進行至15min時,反應物和生成物濃度都減少,說明容器體積增大,故答案為:增大容器體積;
(4)化學平衡常數只與溫度有關,所以要改變平衡常數自由改變溫度,故答案為:C.
點評 本題考查了化學平衡的有關計算,為高考常見題型,側重考查學生的分析、計算能力,會根據化學平衡常數進行有關計算,注意反應方向的判斷,根據濃度變化量確定反應方向,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 麻古(冰毒片劑) | B. | K粉(氯胺酮) | C. | 大麻(四氫大麻酚) | D. | 抗酸藥 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗步驟 | 預期現象 |
| 步驟一:用膠頭滴管取出A試管中的溶液,用水稀釋后,并分裝在試管Ⅰ、Ⅱ中備用 | |
| 步驟二:檢驗Fe3+,往試管Ⅰ中,滴入幾滴KSCN溶液 | 溶液呈現血紅色 |
| 步驟三:檢驗Fe2+,往試管Ⅱ中,滴入少量KMnO4溶液(或先滴入幾滴稀硫酸) | 紫紅色變淺或消褪 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一.
氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 乙醛在催化劑存在的條件下,可以被空氣氧化成乙酸.依據此原理設計實驗制得并在試管C中收集到少量乙酸溶液(如圖所示:試管A中裝有40%的乙醛水溶液、氧化銅粉末;試管C中裝有適量蒸餾水;燒杯B中裝有某液體).已知在60℃~80℃時用雙連打氣球鼓入空氣即可發生乙醛的氧化反應,連續鼓入十幾次反應基本完全.有關物質的沸點見表:
乙醛在催化劑存在的條件下,可以被空氣氧化成乙酸.依據此原理設計實驗制得并在試管C中收集到少量乙酸溶液(如圖所示:試管A中裝有40%的乙醛水溶液、氧化銅粉末;試管C中裝有適量蒸餾水;燒杯B中裝有某液體).已知在60℃~80℃時用雙連打氣球鼓入空氣即可發生乙醛的氧化反應,連續鼓入十幾次反應基本完全.有關物質的沸點見表:| 物質 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸點 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol水的質量為18g/mol | |
| B. | 標準狀況下,3.01×1023個CO2分子的質量為22g | |
| C. | 標準狀況下,1mol任何物質體積約為22.4 L | |
| D. | 二氧化硫的摩爾質量是64 g |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com