

分析 (1)①根據溫度對化學平衡的影響結合圖象分析該反應是放熱反應還是吸熱反應;
②根據T1的T2關系結合圖象分析平衡的移動,根據反應物和生成物物質的量的改變引起化學平衡常數的改變判斷K1、K2的關系;根據圖象中曲線及曲線上、下方區域表示的含義分析,曲線表示平衡狀態,曲線下方表示向正反應方向進行,曲線上方表示向逆反應方向進行;
(2)①根據能量變化示意圖中能量數據的含義來回答;
②由圖甲可知,N2和H2反應生成1molNH3放出的熱量為(Q2-Q1)kJ,注明物質的聚集狀態與反應熱書寫熱化學方程式.
解答 解:(1)①根據圖象可知:升高溫度,SO3的平衡含量減少,說明升高溫度,平衡向逆反應方向移動.根據平衡移動原理:升高溫度,平衡向吸熱反應方向移動,因此2SO2(g)+O2(g)?2SO3(g)的正反應是放熱反應,△H<0;若在恒溫、恒壓條件下向上述平衡體系中通入氦氣,則容器的容積擴大,物質的濃度減小,容器內氣體的壓強減小,平衡向氣體體積增大的方向移動,因此平衡逆向移動.即向左移動,故答案為:<;向左;
②由于升高溫度,平衡逆向移動,所以若溫度為T1、T2,反應的平衡常數分別為K1,K2,則K1>K2;溫度為T1時,反應進行到狀態D時,未達到平衡時的SO3的濃度,所以反應正向進行,則v 正>v逆,故答案為:>;>;
(2)圖示是一定的溫度和壓強下N2(g)和H2(g)反應生成lmol NH3(g)過程中能量變化示意圖,圖中E1 表示的是正反應的活化能(或正反應發生需要的最低能量);E2表示的意義是E2:逆反應的活化能(或逆反應發生需要的最低能量),
故答案為:正反應的活化能;逆反應的活化能;
②根據圖示可知每產生1mol NH3(g)放出能量是(Q2-Q1)kJ,因此工業合成氨的熱化學方程式是$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=(Q1-Q2)kJ/mol,
故答案為:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=(Q1-Q2)kJ/mol.
點評 本題綜合考查化學平衡的影響因素,化學平衡的計算與判斷,為高考常見題型和高頻考點,注意把握圖象的分析與判斷,本題還要注意反應熱與焓變,把握活化能與反應熱的關系,難度不大.


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na2O2與Na2O | B. | Na2O2 | C. | Na2O2與Na | D. | Na和Na2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | 實驗內容 | 實驗現象 | 離子方程式 | 實驗結論 |
| ① | 在FeCl2溶液中滴入適量氯水 | 溶液由淺綠色變為黃色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有還原性 |
| ② | 在FeCl2溶液中加入鋅片 | (不寫) | Zn+Fe2+=Zn2++Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中加入足量鐵粉 | 溶液由黃色變為淺綠色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中滴入適量KI溶液和淀粉溶液 | 變藍色 | 2Fe3++2I-=2Fe2++I2 | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
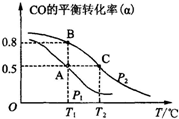 空氣質量與我們的健康息息相關,目前我國通過監測6項污染物的質量濃度來計算空氣質量指數(AQI),SO2、NO2和CO是其中3項中的污染物.
空氣質量與我們的健康息息相關,目前我國通過監測6項污染物的質量濃度來計算空氣質量指數(AQI),SO2、NO2和CO是其中3項中的污染物.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
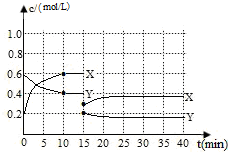 已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.現將一定量NO2和N2O4的混合氣體通入體積為1L的恒溫密閉容器中發生上述反應,反應物濃度隨時間變化關系如下圖所示.X與Y兩條曲線中,Y表示N2O4濃度隨時間的變化
已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.現將一定量NO2和N2O4的混合氣體通入體積為1L的恒溫密閉容器中發生上述反應,反應物濃度隨時間變化關系如下圖所示.X與Y兩條曲線中,Y表示N2O4濃度隨時間的變化查看答案和解析>>
科目:高中化學 來源: 題型:解答題
時間s 濃度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
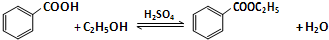
| 物質 | 顏色狀態 | 密度/g/cm3 | 熔點/℃ | 沸點/℃ |
| 苯甲酸 | 白色固體 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 無色液體 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 無色液體 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 無色液體 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 無色液體 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 無色液體 | 0.713 | -116.3 | 34.6 |
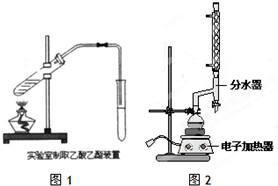
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
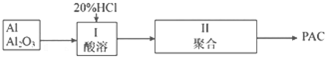
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com