
分析 (1)根據已知反應II-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g),據蓋斯定律計算焓變;
(2)可逆反應達到平衡狀態時,正逆反應速率相等(同種物質)或正逆反應速率之比等于系數之比(不同物質),平衡時各種物質的物質的量、濃度等不再發生變化,由此衍生的一些物理量不變,以此分析解答;
(3)密閉容器中,反應Ⅰ在一定條件達到平衡后,其它條件恒定,能提高CO2轉化率的措施即使得平衡正向移動的因素即可.
解答 解:(1)已知:反應I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反應II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
根據蓋斯定律II-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g);△H=-75.6 kJ•mol-1.
故答案為:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1;
( 2)a.反應物不再轉化為生成物的狀態不能說明正逆反應速率相等,不一定平衡,故a錯誤;
b.平衡常數只受溫度影響,溫度不變,K不變,在非絕熱容器中,溫度不變,K不再增大的狀態不一定平衡,故B錯誤;
c.CO2的轉化率不再增大,證明反應達到了平衡狀態,故C正確;
d.混合氣體的平均相對分子質量等于質量和物質的量的比值,質量不變,物質的量變化,所以平均相對分子質量變化,當進行到不變的狀態是平衡狀態,故d正確;
故選:cd;
(3)A、降低溫度,平衡正向移動,反應物轉化率增大,故A正確;
B、補充CO2會使得轉化率減小,故B錯誤;
C、加入催化劑不會引起平衡的移動,反應物轉化率不變,故C錯誤;
D、移去甲醇,會使得平衡正向移動,反應物的轉化率增加,故D正確.
故選AD.
點評 本題涉及蓋斯定律的使用以及化學平衡移動的影響因素的應用知識,難度中等,注意知識的歸納和梳理是關鍵.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題

| A. | Z、N兩種元素的離子半徑相比,前者較大 | |
| B. | 工業上可通過電解熔融的Z 和N組成的化合物來制取Z單質 | |
| C. | 由X與M兩種元素組成的化合物不能與任何酸反應,但能與強堿反應 | |
| D. | Z的氧化物能分別溶解于Y的氫氧化物和N的氫化物的水溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、NH4+、Cl-、SO42- | B. | Fe2+、H+、SiO32-、ClO- | ||
| C. | Mg2+、K+、OH -、SO42- | D. | K+、Fe3+、NO3-、I- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L1 mol•L-1 FeCl3溶液,含有Fe3+的數目為NA個 | |
| B. | 標準狀況下,22.4L丙烷中碳碳共價鍵數目為2NA | |
| C. | 1L0.5 mol•L-1 氨水溶液中含有0.5NA個OH- | |
| D. | 室溫下H2O2分解得到16 g O2,轉移的電子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 點燃鎂、鋁前應用砂紙打磨,除去表面的氧化膜 | |
| B. | 用砂紙打磨的鋁條,放在酒精燈上加熱至熔化,鋁會滴落下來 | |
| C. | 鐵在氧氣中燃燒的產物主要成分是Fe2O3 | |
| D. | 金屬單質在自然界中都以化合物存在,因為它們都有較強的還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 銀片為正極,發生的反應為:Ag++e-=Ag | |
| B. | 進行實驗時,瓊脂中K+移向Mg(NO3)2溶液 | |
| C. | 取下鹽橋,原電池仍可工作 | |
| D. | 在外電路中,電子從正極流向負極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④ | B. | ①③ | C. | ②③ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

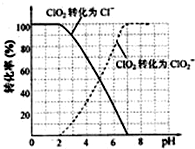
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com