
| A. | 常溫下,pH=3和pH=5的鹽酸各10mL混合,所得溶液的pH=4 | |
| B. | 當溫度不變時,在純水中加入強堿溶液不會影響水的離子積常數 | |
| C. | 液氯雖然不導電,但溶解于水后導電情況良好,因此,液氯也是強電解質 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越強 |
分析 A.常溫下,pH=3和pH=5的鹽酸各10mL混合,混合溶液中c(H+)=$\frac{1{0}^{-3}+1{0}^{-5}}{2}$mol/L,pH=-lgc(H+);
B.離子積常數只與溫度有關;
C.完全電離的電解質是強電解質,在水溶液中或或熔融狀態下能導電的化合物是電解質;
D.溶液中c(H+)越大,溶液的pH越小.
解答 解:A.常溫下,pH=3和pH=5的鹽酸各10mL混合,混合溶液中c(H+)=$\frac{1{0}^{-3}+1{0}^{-5}}{2}$mol/L,pH=-lgc(H+)=-lg $\frac{1{0}^{-3}+1{0}^{-5}}{2}$=-lg5.5×10-4<4,故A錯誤;
B.離子積常數只與溫度有關,溫度不變離子積常數不變,故B正確;
C.完全電離的電解質是強電解質,在水溶液中或或熔融狀態下能導電的化合物是電解質,液氯是單質,既不是電解質也不是非電解質,故C錯誤;
D.溶液中c(H+)越大,溶液的pH越小,溶液的酸性越強,故D錯誤;
故選B.
點評 本題考查基本概念、pH計算等知識點,為高頻考點,側重考查學生分析、判斷及計算能力,注意:離子積常數只與溫度有關,與溶液酸堿性及濃度都無關,易錯選項是B.


科目:高中化學 來源: 題型:解答題
 完成下列問題:
完成下列問題:| 實驗編號 | 待測鹽酸溶液的體積/mL | 滴入NaOH溶液的體積/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 15g甲基(-CH3)所含有的電子數是10 NA個 | |
| B. | 標準狀況下,2.24 L CHCl3的原子總數為0.5 NA個 | |
| C. | 4.2g C3H6中含有的碳碳雙鍵數一定為0.1NA | |
| D. | 常溫下,14g乙烯和丙烯的混合物中總原子數為3NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S(g)+O2(g)=SO2(g)△H3S(s)+O2(g)=SO2(g)△H2,則△H1<△H2 | |
| B. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216kJ•mol-1,則反應總能量>生成物總能量 | |
| C. | 己知C(石墨•s)=C(金剛石•s)△H>0,則石墨比金剛石穩定 | |
| D. | 相同條件下,如果1mol氫原子所具有的能量為E1•1mol氫分子所具有的能量為E2,則2E1=E2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | T(K) | 催化劑 | CO2轉化率(%) | 甲醇選擇性(%) |
| 1 | 543 | 催化劑 A | 12.3 | 42.3 |
| 2 | 543 | 催化劑B | 10.9 | 72.7 |
| 3 | 553 | 催化劑 A | 15.3 | 39.1 |
| 4 | 553 | 催化劑B | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2的轉化率為60% | |
| B. | SO3的產率為60% | |
| C. | 平衡時總壓強與起始壓強之比為7:8 | |
| D. | 平衡時V(SO2):V(O2):V(SO3)=3:3:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
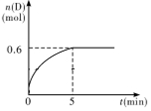
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.57 mol | B. | 2.25mol | C. | 2 mol | D. | 0.63mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉與水反應:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 鈉與硫酸銅溶液的反應:2Na+Cu2+═2Na++Cu | |
| C. | 鐵與稀鹽酸的反應:2Fe+6H+═2 Fe 3++3H2↑ | |
| D. | 鋁粉和氫氧化鈉溶液的反應:2Al+2 OH-═2AlO2-+H2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com