
【題目】我國科學家在1965年9月首先用人工方法合成牛胰島素。為了證實人工合成的胰島素與天然的是否是同一物質,在人工合成牛胰島素過程中摻入了放射性14C,然后將人工合成的牛胰島素與天然的混合得到了放射性14C分布均勻的結晶物,從而證明了兩者都是同一種物質,為我國在國際上首先合成具有生物活性牛胰島素提供了有力證據。在人工合成過程中摻入放射性14C的用途是 ( )
A. 催化劑 B. 媒介質 C. 組成元素 D. 示蹤原子
科目:高中化學 來源: 題型:
【題目】從一種含銀礦(含Ag、Zn、Cu、Pb及少量SiO2)中提取Ag、Cu及Pb的工藝流程如下:
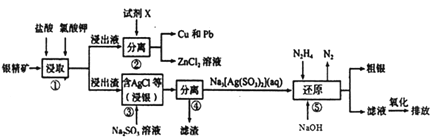
(1)步驟①提高礦物中金屬離子浸取率,除可改變鹽酸的濃度和氯酸鉀的量外,還可采取的措施是__________(寫出兩種即可)
(2)步驟②中試劑X為______ (填化學式,下同);步驟④濾渣的成分為_______。
(3)步驟③發生反應的化學方程式為____________________。
(4)步驟⑤發生反應的離子方程式為____________________;其中N2H4(肼) 的電子式為____。
(5)“還原”后的“濾液”經氧化后,其中的溶質主要為_______。
(6) 已知常溫下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。若在AgC1的懸濁液中加入NaCl 固體,AgCl 沉淀的溶解度_____ (填“升高”、“不變”或“降低”),往AgCl 的懸濁液中滴加NaI溶液,當AgCl 開始轉化為AgI時,I-的濃度必須不低于_____mol/L (不用化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬酸鈉晶體(Na2MoO4·2H2O)是無公害型冷卻水系統的金屬緩蝕劑,由鉬精礦(主要成分是MoS2,含少量PbS等)制備鉬酸鈉晶體的部分流程如圖所示:
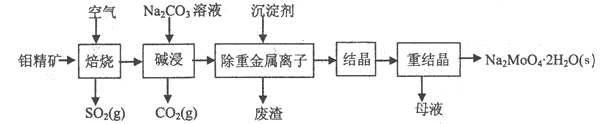
(1)Na2MoO4·2H2O中鉬元素的化合價為______;
(2)焙燒時為了使鉬精礦充分反應,可采取的措施是_______(答出一條即可);
(3)試配平焙燒過程中鉬精礦發生的主要反應的化學方程式
為__MoS2+__O2![]() __MoO3+___SO2,該反應中氧化產物是________(填化學式)
__MoO3+___SO2,該反應中氧化產物是________(填化學式)
(4)堿浸時,MoO3與Na2CO3溶液反應的離子方程式為___________;
(5)下圖是碳鋼在3種不同介質中的腐蝕速率實驗結果:
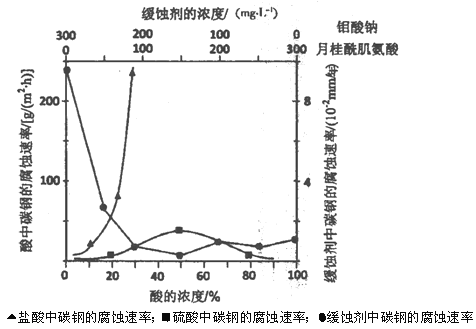
①碳鋼在鹽酸和硫酸中腐蝕速率隨酸的濃度變化有明顯差異,其原因可能是____。
②空氣中鉬酸鹽對碳鋼的緩蝕原理是在鋼鐵表面形成FeMoO4—Fe2O3保護膜。
密閉式循環冷卻水系統中的碳鋼管道緩蝕,除需加入鉬酸鹽外還需加入NaNO2。則NaNO2的作用是__。
(6)鋰和二硫化鉬形成的二次電池的總反應為:xLi+nMoS2![]() Lix(MoS2)n。則電池放電時的正極反應式是:__________________。
Lix(MoS2)n。則電池放電時的正極反應式是:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】部分弱酸的電離平衡常數如下表:
弱酸 | HCOOH | HClO |
|
|
電離平衡常數 |
|
|
|
|
(1)室溫下![]()
![]()
![]()
![]()
![]() 溶液的pH由大到小的關系為______.
溶液的pH由大到小的關系為______.
(2)濃度均為![]() 的
的![]() 和
和![]() 的混合溶液中,
的混合溶液中, ![]() 、
、![]() 、
、![]() 、
、![]() 濃度從大到小的順序為______.
濃度從大到小的順序為______.
(3)少量![]() 通入到過量的NaClO溶液中發生反應的離子方程式______.
通入到過量的NaClO溶液中發生反應的離子方程式______.
(4)常溫下, ![]() 的HCOOH溶液與
的HCOOH溶液與![]() 的NaOH溶液等體積混合后,溶液中離子濃度由大到小的順序為______.
的NaOH溶液等體積混合后,溶液中離子濃度由大到小的順序為______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關硅及硅的化合物的敘述中,正確的是( )
A. 硅是光導纖維的主要成分 B. 硅是構成巖石與許多礦物的基本元素
C. SiO2是酸性氧化物,不與任何酸發生反應 D. 可以通過SiO2一步制得硅酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機化合物A是一種農藥生產的中間體,A在一定條件下可發生如圖轉化:

請回答下列問題:
(1)![]() 分子中不含氧官能團的名稱為 ______ .
分子中不含氧官能團的名稱為 ______ .
(2)![]() 不能發生反應的類型有 ______
不能發生反應的類型有 ______ ![]() 填字母
填字母![]() .
.
![]() 取代反應
取代反應![]() 消去反應
消去反應![]() 加成反應
加成反應![]() 氧化反應
氧化反應
(3)反應![]() 的化學方程式為 ______ .
的化學方程式為 ______ .
(4)寫出B到C的離子方程式 ______ .
(5)![]() 在一定條件下反應能生成高分子化合物,寫出此高分子化合物所有可能的結構簡式: ______ .
在一定條件下反應能生成高分子化合物,寫出此高分子化合物所有可能的結構簡式: ______ .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】基礎知識填空:
(1)氫氧化鐵膠體制備的化學方程式_______________,所得分散系及下列物質分別用激光照射,與該分散系現象相同的是______。
A、淀粉溶液 B、澄清水 C、納米鐵 D、豆漿
(2)裝置的選擇:
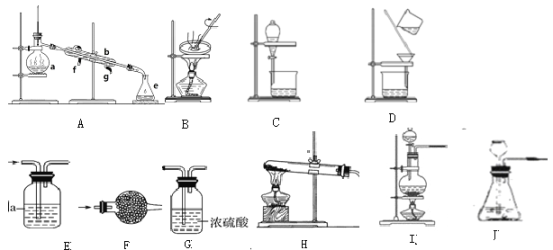
a、干燥氨氣______。
b、分離植物油和水______。
c、檢驗CO中的是否含有CO2______。
d、分離碘和四氯化碳______。
e、實驗室用氫氧化鈣和氯化銨共熱制氨氣______。
f、實驗室用稀鹽酸和石制二氧化碳______。
(3)以物質的量為中心的計算
①、12.4gNa2X中含Na+0.4mol,則X的相對原子質量是______。
②、500mL質量分數為49%的硫酸溶液,密度為1.392g/cm3,則溶液的物質的量濃度為______________mol/L,其中含有SO42-的數目約為______(保留三位有效數字)。
(4)一定物質的量濃度溶液的配制:
①、實驗室要配制480mL0.25mol·L-1的FeSO4溶液,需稱量綠礬(FeSO4·7H2O)______g,
②、由于錯誤操作,使得實際濃度比所要求的偏小的是______(填寫編號)。
A 稱量綠礬時,左碼右物
B 使用容量瓶配制溶液時,俯視液面定容,所得溶液的濃度
C 沒有用蒸餾水洗燒杯2~3次,并將洗液移入容量瓶中
D 容量瓶剛用蒸餾水洗凈,沒有干燥
E 定容時,滴加蒸餾水,先使液面略高于刻度線,再吸出少量水使液面凹面與刻度線相切
F 把配好的溶液倒入剛用蒸餾水洗凈的試劑瓶中備用
③、定容時,若加蒸餾水時不慎超過刻度線,處理方法是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CaSO4·2H2O受熱會逐步失去結晶水。取純凈的CaSO4·2H2O固體3.44 g進行加熱,測定固體質量隨溫度的變化情況如右圖所示。C點固體的化學式是________________。T3~T4溫度段加熱固體所產生的氣體是形成酸雨的主要物質之一,則D~E段發生反應的化學方程式為____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于硅及其化合物的說法中,正確的是( )
A.硅是常用的半導體材料,可用于制造光導纖維B.二氧化硅是酸性氧化物,故不與任何酸反應
C.硅酸是一種二元弱酸,其酸性強于碳酸D.制造普通玻璃的主要原料是純堿、石灰石和石英
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com