
 某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.
某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.| 分組實驗 | 催化劑 | |
| ① | 10mL 5% H2O2溶液 | 無 |
| ② | 10mL 2% H2O2溶液 | 無 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
 .
.分析 (1)實驗③中雙氧水在氯化鐵作催化劑分解生成水和氧氣,據此寫出H2O2分解反應方程式并根據化合價變化標明電子轉移的方向和數目;
(2)實驗①和②的濃度不同;為了便于比較,應在相同的條件下利用一個變量來比較;
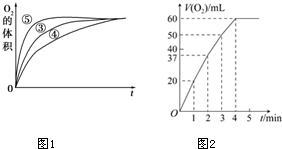
(3)由圖可知,⑤的反應速率最大,④的反應速率最小,以此來解答;
(4)根據隨著反應的進行H2O2的濃度變化判斷反應速率變化的原因;由圖可知,過氧化氫分解完全生成氧氣60mL,根據n=$\frac{V}{{V}_{m}}$計算氧氣的物質的量,進而計算過氧化氫的物質的量,再根據c=$\frac{n}{V}$計算其濃度.
解答 解:(1)實驗③中雙氧水分解的方程式為:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑,反應中雙氧水既是氧化劑也是還原劑,雙氧水中氧元素化合價為-1價,變成氧氣失去2個電子,生成水得到2個電子,用雙線橋標明電子轉移的方向和數目為: ,
,
故答案為: ;
;
(2)實驗①和②的濃度不同,則該實驗的目的為探究濃度對化學反應速率的影響;為了便于比較,應在相同的條件下利用一個變量來比較,
則向反應物中加入等量同種催化劑(或將盛有反應物的試管放在同一熱水浴中),
故答案為:探究反應物濃度對反應速率的影響;向反應物中加入等量同種催化劑(或將盛有反應物的試管放在同一熱水浴中);
(3)由圖可知,⑤的反應速率最大,④的反應速率最小,結合實驗方案可知,堿性環境能增大H2O2分解的速率,酸性環境能減小H2O2分解的速率,
故答案為:堿性;酸性;
(4)反應速率變化的原因為:隨著反應的進行,H2O2的濃度減小,反應速率減慢;
由圖可知,過氧化氫分解完全生成氧氣60mL,氧氣的物質的量為:$\frac{0.06L}{22.4L/mol}$=$\frac{3}{1120}$mol,由反應2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,可知過氧化氫的物質的量為:$\frac{3}{1120}$mol×2=$\frac{3}{560}$mol,故過氧化氫濃度為:$\frac{\frac{3}{560}mol}{0.05L}$=0.11mol/L,
故答案為:隨著反應的進行,H2O2 的濃度減小,反應速率減慢;0.11mol/L.
點評 本題考查影響化學反應速率的因素,題目難度中等,較好的考查學生實驗設計、數據處理、圖象分析的綜合能力,注意熟練掌握影響化學反應速率的因素.


 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 若pH>7,則一定是c1V1≥c2V2 | |
| B. | 在任何情況下都是c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 當醋酸和氫氧化鈉溶液恰好完全反應后,滴加酚酞溶液,顏色變紅 | |
| D. | 反應的離子方程式為:H++OH-═H20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 實驗現象及相關結論 |
| ①取少量電解質溶液于試管中,用pH試紙測其pH. | →試紙呈深藍色,經比對溶液的pH約為14,說明溶液中有殘余的KOH. |
| ②繼續加入足量1mol•L-1HCl 溶液,再加入少量0.1mol•L-1BaCl2溶液,振蕩. | →若有白色沉淀產生,則溶液中含有K2SO4. →若無白色沉淀產生,則溶液中沒有K2SO4. |
| ③另取少量電解質溶液于試管中,先加1mol•L-1的H2SO4酸化,再滴入2~3滴0.01mol•L-1KMnO4酸性溶液,振蕩. | →若KMnO4溶液紫紅色褪去,則說明溶液中含有K2SO3,若KMnO4溶液紫紅色不褪,則說明溶液不含K2SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
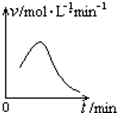 已知氯酸鉀和亞硫酸氫鈉發生氧化還原反應時,生成-1價的氯和+6價的硫的化合物,反應速率v和反應時間t的關系如圖所示.
已知氯酸鉀和亞硫酸氫鈉發生氧化還原反應時,生成-1價的氯和+6價的硫的化合物,反應速率v和反應時間t的關系如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

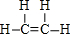 ;B的結構簡式:CH3CH3;
;B的結構簡式:CH3CH3;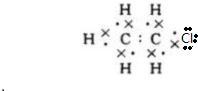 ;D的官能團名稱羥基;G官能團的結構簡式-COOH.
;D的官能團名稱羥基;G官能團的結構簡式-COOH.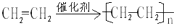 (反應類型加聚反應).
(反應類型加聚反應).查看答案和解析>>
科目:高中化學 來源: 題型:填空題
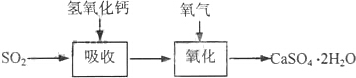
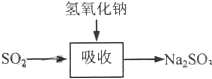
| 試劑 | Ca(OH)2 | NaOH |
| 價格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 瓶中氣體的黃綠色逐漸變淺,內壁有油狀液滴形成 | |
| B. | 若日光直射可能發生爆炸 | |
| C. | 甲烷與氯氣發生了取代反應 | |
| D. | 生成物只有 CH3Cl、CH2Cl2、CHCl3、CCl4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com