
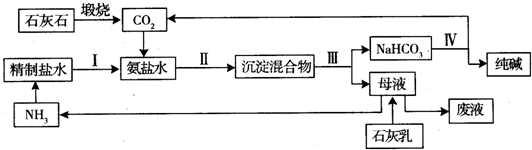
分析 (1)將硫酸鈉、石灰石和足量煤混合,高溫下共熔制得碳酸鈉,反應有硫化鈣生成,S元素發生還原反應,C發生氧化反應生成CO,反應方程式為:Na2SO4+CaCO3+4C $\frac{\underline{\;高溫\;}}{\;}$Na2CO3+CaS+4CO↑,根據碳酸鈉和轉移電子之間的關系式計算轉移電子物質的量;
(2)石灰石煅燒發生的反應方程式為CaCO3$\frac{\underline{\;高溫\;}}{\;}$CaO+CO2↑,精鹽溶液中通入氨氣,氨氣和水反應生成一水合氨,將CO2通入氨鹽水中發生反應NaCl+NH4HCO3=NaHCO3↓+NH4Cl,因為碳酸氫鈉溶解度小于碳酸氫銨,所以得到NaHCO3沉淀,過濾得到NaHCO3,向母液中加入Ca(OH)2得到NH3,將NaHCO3分解得到Na2CO3和CO2,反應中CO2和NH3能重復利用; ①鎂離子用石灰乳或生石灰除去、鈣離子用碳酸根離子除去;
②碳酸氫鈉溶解度小于碳酸氫銨,所以氨氣、二氧化碳和水、NaCl反應生成溶解度較小的NaHCO3;
在流程圖中能參加反應且能生成的物質能循環利用;
③根據各設備的用途判斷;
④煅燒石灰石、加熱碳酸氫鈉都發生分解反應,氨氣和水反應為化合反應,碳酸氫銨和氯化鈉 發生復分解反應;
(3)加入氨氣和氯化鈉后還生成可溶性的銨鹽.
解答 解:(1)將硫酸鈉、石灰石和足量煤混合,高溫下共熔制得碳酸鈉,反應有硫化鈣生成,S元素發生還原反應,C發生氧化反應生成CO,反應方程式為:Na2SO4+CaCO3+4C $\frac{\underline{\;高溫\;}}{\;}$Na2CO3+CaS+4CO↑,該反應中C元素化合價由0價變為+2價、S元素化合價由+6價變為-2價,則轉移電子個數是8,即生成1mol碳酸鈉轉移8mol電子,
故答案為:8mol;
(2)石灰石煅燒發生的反應方程式為CaCO3$\frac{\underline{\;高溫\;}}{\;}$CaO+CO2↑,精鹽溶液中通入氨氣,氨氣和水反應生成一水合氨,將CO2通入氨鹽水中發生反應NaCl+NH4HCO3=NaHCO3↓+NH4Cl,因為碳酸氫鈉溶解度小于碳酸氫銨,所以得到NaHCO3沉淀,過濾得到NaHCO3,向母液中加入Ca(OH)2得到NH3,將NaHCO3分解得到Na2CO3和CO2,反應中CO2和NH3能重復利用; ①用石灰乳或生石灰與鎂離子溶液反應生成氫氧化鎂沉淀而除去鎂離子,用碳酸鈉溶液和鈣離子反應生成碳酸鈣沉淀而除去鈣離子,故答案為:Ca(OH)2(或CaO);Na2CO3;
②碳酸氫鈉溶解度小于碳酸氫銨,所以氨氣、二氧化碳和水、NaCl反應生成溶解度較小的NaHCO3,反應方程式為NH3+H2O+NaCl+CO2=NaHCO3↓+NH4Cl(或NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl),
在流程圖中能參加反應且能生成的物質能循環利用,能循環利用的物質有CO2和NH3,
故答案為:NH3+H2O+NaCl+CO2=NaHCO3↓+NH4Cl(或NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl);CO2和NH3;
③石灰窯煅燒石灰石、碳酸化塔吸收二氧化碳、蒸氨塔蒸發母液得到氨氣、吸氨塔吸收氨氣,所以沒有用到的是沸騰爐,
故選B;
④煅燒石灰石、加熱碳酸氫鈉都發生分解反應,氨氣和水反應為化合反應,碳酸氫銨和氯化鈉 發生復分解反應,所以沒有涉及的反應是置換反應,故選C;
(3)加入氨氣和氯化鈉后還生成可溶性的銨鹽,為NH4Cl,故答案為:NH4Cl.
點評 本題以氯堿工業為載體考查物質制備,為高頻考點,明確流程圖中發生的反應、用到的裝置、物質的性質是解本題關鍵,注意:向食鹽水中通入氨氣和二氧化碳時應該先通入氨氣后通入二氧化碳,因為氨氣溶解性大、二氧化碳溶解性小,為易錯點.


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:選擇題
 我國自行設計和生產的電動燃料汽車,該車裝有“綠色心臟”--質子交換膜燃料電池,其工作原理如圖所示.則下列敘述正確的( )
我國自行設計和生產的電動燃料汽車,該車裝有“綠色心臟”--質子交換膜燃料電池,其工作原理如圖所示.則下列敘述正確的( )| A. | 通入O2的電極發生氧化反應 | |
| B. | 通入H2的電極是正極 | |
| C. | 正極的電極反應為O2+4H++4e-═2H2O | |
| D. | 總反應的化學方程式為:O2+2H2$\frac{\underline{\;點燃\;}}{\;}$2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2SO4(HCl):AgNO3溶液、過濾 | B. | KNO3(K2SO4):Ba(NO3)2溶液、過濾 | ||
| C. | Cu(CuO):鹽酸、過濾 | D. | CaCO3(CaO):水、過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
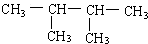 系統命名:2,3-二甲基丁烷
系統命名:2,3-二甲基丁烷
 的分子式:C4H8O
的分子式:C4H8O查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
| 平衡氣體總濃度/10-3mol•L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A. | 混合氣體的平均相對分子質量$\overline{M}$不再隨時間變化的反應達到平衡狀態 | |
| B. | 15.0℃時NH2COONH4(s)分解的平衡常數為2.0×10-9(mol/L)3 | |
| C. | 該反應△H>0,p2=2p1 | |
| D. | 若在恒溫下將平衡體系體積減半,再達平衡后,c(NH3)和c(CO2)均比原平衡大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S(s)+O2(g)═SO2(g),反應放出的熱量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g),反應放出的熱量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2的鍵能總和大于1 mol硫和1 mol氧氣的鍵能之和 | |
| D. | 1 mol SO2的鍵能總和小于1 mol硫和1 mol氧氣的鍵能之和 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
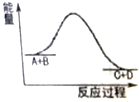
| A. | 該反應為吸熱反應 | |
| B. | 該反應只有在加熱的條件下才能進行 | |
| C. | 反應物的總能量高于生成物的總能量 | |
| D. | 反應物中的化學鍵斷裂要放出熱量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com