
 ,寫出M2Z2與水反應的離子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
,寫出M2Z2與水反應的離子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.分析 原子序數(shù)由小到大排列的四種短周期元素X、Y、Z、W,在周期表中X是原子半徑最小的元素,則X為H元素;Y、Z左右相鄰,Z、W位于同主族,結合原子序數(shù)可知Y、Z處于第二周期,W處于第三周期,設Y的原子序數(shù)為a,則Z的原子序數(shù)為a+1,W的原子序數(shù)為a+9,四種元素的原子序數(shù)之和為32,則:1+a+a+1+a+9=32,解得a=7,故Y為N元素、Z為O元素、W為S元素.M元素與X同主族,與W同周期,則M為Na.
(1)根據(jù)上述分析可知,M為鈉元素;
(2)非金屬性越強,氫化物越穩(wěn)定;
(3)Na2O2屬于離子化合物,Na2O2與水反應生成氫氧化鈉與氧氣;
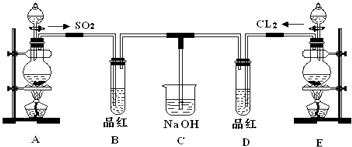
(4)由H、N、O、S四種元素中的三種組成的一種強酸,該強酸的稀溶液能與銅反應,則該酸為硝酸;(5)由H、N、O、S四種元素組成的一種離子化合物A:①1molA能與足量NaOH濃溶液反應生成標準狀況下44.8L氣體,說明該物質陽離子為NH4+,且1molA中含有2molNH4+,則A為硫酸銨或亞硫酸銨,②A既能與鹽酸反應,又能與氯水反應,故A為亞硫酸銨,則B為SO2;
(6)由H、N、O、S和Fe五種元素組成的式量為392的化合物Y,Y的溶液加入過量濃NaOH溶液并加熱,產生白色沉淀和無色刺激性氣味氣體.過一段時間白色沉淀變?yōu)榛揖G色,最終變?yōu)榧t褐色,可知Y中含有Fe2+、NH4+,另取B的溶液,加入過量BaCl2溶液產生白色沉淀,加鹽酸沉淀不溶解,則B中含有硫酸根離子,又1mol B中含有6mol結晶水,令C的化學式為x(NH4)2SO4•yFeSO4•6H2O,結合其相對分子質量確定.
解答 解:原子序數(shù)由小到大排列的四種短周期元素X、Y、Z、W,在周期表中X是原子半徑最小的元素,則X為H元素;Y、Z左右相鄰,Z、W位于同主族,結合原子序數(shù)可知Y、Z處于第二周期,W處于第三周期,設Y的原子序數(shù)為a,則Z的原子序數(shù)為a+1,W的原子序數(shù)為a+9,四種元素的原子序數(shù)之和為32,則:1+a+a+1+a+9=32,解得a=7,故Y為N元素、Z為O元素、W為S元素.M元素與X同主族,與W同周期,則M為Na,
(1)根據(jù)上述分析可知,M為Na元素,故答案為:Na;
(2)非金屬性O>S,故氫化物穩(wěn)定性H2O>H2S,故答案為:H2O;H2S;
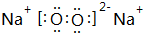
(3)Na2O2屬于離子化合物,電子式為 ,Na2O2與水反應生成氫氧化鈉與氧氣,反應離子方程式為:2Na2O2+2H2O=4Na++4OH-+O2↑,
,Na2O2與水反應生成氫氧化鈉與氧氣,反應離子方程式為:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案為: ;2Na2O2+2H2O=4Na++4OH-+O2↑;
;2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)由H、N、O、S四種元素中的三種組成的一種強酸,該強酸的稀溶液能與銅反應,該酸為HNO3,Cu與稀硝酸反應得到硝酸銅、NO與水,反應離子方程式為:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,
故答案為:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(5)由H、N、O、S四種元素組成的一種離子化合物A,則A為銨鹽.①1molA能與足量NaOH濃溶液反應生成標準狀況下44.8L氣體,即氨氣為2mol,即1molA含有2mol銨根離子;②A能與鹽酸反應產生氣體B,該氣體能與氯水反應,B為二氧化硫,可推知A為(NH4)2SO3,B為SO2,二氧化硫與氯水反應得到HCl與硫酸,反應離子方程式為:SO2+Cl2+2H2O=4H++2Cl-+SO42-,
故答案為:(NH4)2SO3;SO2+Cl2+2H2O=4H++2Cl-+SO42-;
(6)由H、N、O、S和Fe五種元素組成的相對分子質量為392的化合物C,1mol C中含有6mol結晶水.向C的溶液中加入過量濃NaOH溶液并加熱,產生白色沉淀和無色有刺激性氣味的氣體,白色沉淀迅速變?yōu)榛揖G色,最終變?yōu)榧t褐色,說明C中含有Fe2+和NH4+,另取少量C的溶液,向其中加入過量BaCl2溶液時產生白色沉淀,再加入稀鹽酸沉淀不溶解,說明C中含有SO42-,
令C的化學式為x(NH4)2SO4•yFeSO4•6H2O,則:(96+36)x+(96+56)y+108=392,則x=y=1,故C化學式為:(NH4)2SO4•FeSO4•6H2O,
(NH4)2Fe(SO4)2•6H2O與Na2O2按物質的量比1:2在溶液中反應,反應方程式為:4(NH4)2Fe(SO4)2•6H2O+8Na2O2=4Fe(OH)3+8NH3↑+3O2↑+8Na2SO4+22H2O,
故答案為:(NH4)2Fe(SO4)2•6H2O;4(NH4)2Fe(SO4)2•6H2O+8Na2O2=4Fe(OH)3+8NH3↑+3O2↑+8Na2SO4+22H2O.
點評 本題考查位置結構性質的應用、無機物推斷等,明確Y、Z、W的位置及原子序數(shù)的關系來推斷元素是關鍵,需要學生熟練掌握元素化合物性質,難度較大.


 優(yōu)秀生應用題卡口算天天練系列答案
優(yōu)秀生應用題卡口算天天練系列答案 浙江之星課時優(yōu)化作業(yè)系列答案
浙江之星課時優(yōu)化作業(yè)系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③④⑤⑦⑨ | B. | ①②⑤⑥⑧ | C. | ③④⑤⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 天然氣(主要成分甲烷)含有少量含硫化合物[硫化氫、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氫氧化鈉溶液洗滌除去.
天然氣(主要成分甲烷)含有少量含硫化合物[硫化氫、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氫氧化鈉溶液洗滌除去. ;羰基硫分子的電子式為
;羰基硫分子的電子式為 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com