
【題目】I.AG七種元素中,除F外其他均為短周期主族元素,它們的原子結構或性質如下表所示:
元素 | 原子結構或性質 |
A | 其形成的一種同位素原子在考古中可推測化石的年代 |
B | 與A同周期,其最高價氧化物的水化物無論濃、稀溶液均有強氧化性 |
C | 地殼中含量最多的元素 |
D | D原子的最外層電子數與其電子層數相同,是地殼中含量多的金屬元素 |
E | 其單質主要存在于火山口附近 |
F | 生活中常見的金屬,它的某種氧化物具有磁性 |
G | G原子與D原子同周期,且原子半徑是同周期元素中最大的 |
請回答下列問題:
(1)A在元素周期表中的位置是_______;F的原子結構示意圖是_____________。
(2)下列事實能證明C和E的非金屬性強弱的是_____。(填序號)
①常溫下,C的單質呈氣態,E的單質呈固態②C的氣態氫化物的溫定性強于E的氣態氫化物的溫定性③C與E形成的化合物中,E呈正價④E的氫化物的沸點高于于C的氫化物的沸點
(3)由A、B、C和氫元素四種元素所形成的陰、陽離子數目之比為1:1的離子化合物是______(填化學式),它與足量NaOH溶液在加熱時反應的離子方程式為:_______。
(4)A的氫化物有多種,1 molA的某種氫化物分子中含有14mol電子,請寫出該氫化物的電子式:______。己知在25℃、101kPa下,1g該氫化物在足量氧氣中完全燃燒生成液態水時放出的熱量為40kJ,寫出該氫化物燃燒熱:_________。
II.甲、乙、丙,丁均為上述元素所形成的物質,甲是單質。它們之間有如下的反應關系:

(1)若乙為淡黃色固體,②③反應均用到同一種液態氫化物,丁物質常用于食品工業。乙所含化學鍵的類型是________。寫出乙→丙的化學方程式:__________。
(2)若丁物成質具有兩性,②③反應均要用強堿溶液,④反應是通入過量的—種引起溫室效應的主要氣體。寫出丙→丁的離子方程式:__________。室溫下,若由丁物質形成的水溶液中甲離子濃度為1.3×10-6 mol·L-1,則該溶液的pH為______。
(丁的Ksp為1.3×10-33)
【答案】 笫二周期第IVA族 ![]() ②③ NH4HCO3 NH4++HCO3-+2OH-
②③ NH4HCO3 NH4++HCO3-+2OH-![]() CO32-+NH3↑+2H2O
CO32-+NH3↑+2H2O ![]() 1040 kJ·mol-1 離子鍵與共價鍵 2Na2O2+2H2O=4NaOH+O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或[Al(OH)4]-+CO2=Al(OH)3↓+HCO3- 5
1040 kJ·mol-1 離子鍵與共價鍵 2Na2O2+2H2O=4NaOH+O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或[Al(OH)4]-+CO2=Al(OH)3↓+HCO3- 5
【解析】I.本題考查元素周期表和元素周期律的應用,(1)A的一種同位素可以推測化石的年代,A為C,位于第三周期IVA族;F生活中常見的金屬,它的某種氧化物具有磁性,此氧化物是Fe3O4,即F為Fe,位于第四周期VIIIA族,第26號元素,原子結構示意圖為![]() ;(2)①非金屬性的強弱,與物質的狀態無關,故①錯誤;②非金屬性越強,其氫化物的穩定性越強,因此C的非金屬性強于E,故②正確;③非金屬性的強,得電子能力強,表現負價,因此C的非金屬性強于E,故③正確;④非金屬性的強弱與熔沸點高低無關,故④錯誤;(3)B與C同周期,B的最高價氧化物的水化物無論濃、稀溶液均有強氧化性,因此B為N,C是地殼中含量最多的元素,即C為O,四種元素組成陰陽離子,化合物是離子化合物,陰陽離子個數比為1:1,即化合物是NH4HCO3,與足量NaOH溶液在加熱時發生的離子反應是NH4++HCO3-+2OH-
;(2)①非金屬性的強弱,與物質的狀態無關,故①錯誤;②非金屬性越強,其氫化物的穩定性越強,因此C的非金屬性強于E,故②正確;③非金屬性的強,得電子能力強,表現負價,因此C的非金屬性強于E,故③正確;④非金屬性的強弱與熔沸點高低無關,故④錯誤;(3)B與C同周期,B的最高價氧化物的水化物無論濃、稀溶液均有強氧化性,因此B為N,C是地殼中含量最多的元素,即C為O,四種元素組成陰陽離子,化合物是離子化合物,陰陽離子個數比為1:1,即化合物是NH4HCO3,與足量NaOH溶液在加熱時發生的離子反應是NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O;(4)此物質屬于烴,1mol烴中含有14mol電子,一個碳原子有6個電子,因此此烴為C2H2,其電子式為
NH3↑+CO32-+2H2O;(4)此物質屬于烴,1mol烴中含有14mol電子,一個碳原子有6個電子,因此此烴為C2H2,其電子式為![]() ;燃燒熱是1mol可燃物完全燃燒生成穩定的氧化物所放出的熱量,因此1molC2H2的燃燒熱是40×26kJ·mol-1=1040kJ·mol-1;II.考查無機推斷,(1)乙為淡黃色固體,乙是由單質甲產生,因此乙為Na2O2,甲為Na,②③與同一種液態氫化物反應,即與水反應,則丙為NaOH,丁物質常用于食品工業,因此丁為NaHCO3,Na2O2的電子式為:
;燃燒熱是1mol可燃物完全燃燒生成穩定的氧化物所放出的熱量,因此1molC2H2的燃燒熱是40×26kJ·mol-1=1040kJ·mol-1;II.考查無機推斷,(1)乙為淡黃色固體,乙是由單質甲產生,因此乙為Na2O2,甲為Na,②③與同一種液態氫化物反應,即與水反應,則丙為NaOH,丁物質常用于食品工業,因此丁為NaHCO3,Na2O2的電子式為:![]() ,還有離子鍵和非極性共價鍵,乙→丙的反應方程式為2Na2O2+2H2O=4NaOH+O2↑;(2)丁物質具有兩性,且反應④通入過量的一種引起溫室效應的氣體,此氣體為CO2,即丁為Al(OH)3,因此甲為Al,②③均要強堿溶液,則丙為NaAlO2,乙為鋁鹽,丙→丁的離子反應方程式為AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,根據溶度積進行計算,c(OH-)=
,還有離子鍵和非極性共價鍵,乙→丙的反應方程式為2Na2O2+2H2O=4NaOH+O2↑;(2)丁物質具有兩性,且反應④通入過量的一種引起溫室效應的氣體,此氣體為CO2,即丁為Al(OH)3,因此甲為Al,②③均要強堿溶液,則丙為NaAlO2,乙為鋁鹽,丙→丁的離子反應方程式為AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,根據溶度積進行計算,c(OH-)= 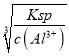 =
=![]() =10-9mol·L-1,c(H+)=Kw/c(OH-)=10-14/10-9mol·L-1=10-5mol·L-1,即pH=5。
=10-9mol·L-1,c(H+)=Kw/c(OH-)=10-14/10-9mol·L-1=10-5mol·L-1,即pH=5。


 一本好題口算題卡系列答案
一本好題口算題卡系列答案科目:高中化學 來源: 題型:
【題目】在一個恒溫恒容的密閉容器中充入1 mol HI,建立如下平衡:2HI(氣)![]() H2(氣)+I2(氣),測得HI的轉化率為a%。保持恒溫恒容,在上述平衡體系中再充入2molHI,待新平衡建立后HI的轉化率為b%,則a與b的關系是
H2(氣)+I2(氣),測得HI的轉化率為a%。保持恒溫恒容,在上述平衡體系中再充入2molHI,待新平衡建立后HI的轉化率為b%,則a與b的關系是
A.a>b B.a<b C.a=b D.無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
① 1 mol鐵在一定條件下分別與氧氣、氯氣、硫完全反應轉移電子數均為2NA
②質子數為92、中子數為142的鈾(U)原子: ![]() U
U
③向苯酚鈉溶液中通入少量的 CO2:CO2 + H2O+ 2C6H5O-![]() 2C6H5OH + CO32-
2C6H5OH + CO32-
④在由水電離出的c (OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤冰中既存在范德華力,又存在氫鍵
⑥1, 3-二甲基丁烷:![]()
A. ②⑤⑥ B. ②④ C. ④⑤ D. ①③⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,冰醋酸加水稀釋過程中溶液的導電能力如圖所示,請回答:

(1)O點為什么不導電_________________;
(2)a、b、c三點溶液c(H+)由小到大的順序 是___________;
(3)a、b、c三點中醋酸的電離程度最大的是 _______點。
(4)若要把b點溶液中c(CH3COO-)、c(OH-)均減小,可采用的方法是___________(選擇正確的選項)
A.加水 B.加NaOH C.加H2SO4 D.加Na2CO3
(5)若要使c點溶液中的c(CH3COO-)提高,可以采取下列措施中的________(填字母 序號)。
A.加熱 B.加NaOH固體 C.加水 D.加固體CH3COONa
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在化學上經常使用氫核磁共振譜,它是根據不同化學環境的氫原子在氫核磁共振譜中給出的信號不同來確定有機物分子中的不同氫原子。下列有機物分子在氫核磁共振譜中只給出一種信號的是
A. CH3 O CH3 B. CH3 CH2OH C. HCOOH D. CH3COOCH3
查看答案和解析>>
科目:高中化學 來源: 題型:
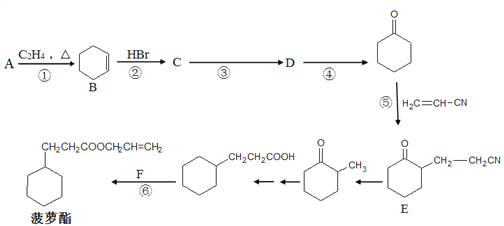
【題目】菠蘿酯是一種帶有濃郁的菠蘿香氣和香味的食用香料,其合成路線如下(部分反應條件及產物已略去):
請回答下列問題:
(1) A可用于制備順丁橡膠(順式聚1,3-丁二烯),順丁橡膠的結構簡式為_________,若順丁橡膠的平均相對分子質量為540108,則平均聚合度為__________。
(2) F的結構簡式為__________,反應④的條件是________________。
(3) ①一⑥反應中屬于取代反應的是__________。
(4) 下列有關B的說法正確的是__________(填字母序號)。
a. 元素分析儀可確定B的實驗式為C6H10
b. 質譜儀可檢測B的最大質荷比的數值為82
c. 紅外光譜儀可測定B中六個碳原子一定在同一平面上
d. 核磁共振儀可測定B有兩種類型氫原子吸收峰
(5) 寫出反應③的化學方程式_________________。
(6) 同時滿足下列條件的E的同分異構體的數目為__________種。
①遇氯化鐵溶液顯紫色 ②苯環上只有2個取代基且處于對位
(7) 參照上述合成路線,現僅以A為有機原料,無機試劑任選,設計制備![]() 的合成路線。
的合成路線。
已知:①反應物分子的環外雙鍵比環內雙鍵更容易被氧化;
②![]() (R,R’代表烴基或氫)
(R,R’代表烴基或氫)
___________________________________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配制一定體積,一定物質的量濃度的溶液時,下列操作會使配得的溶液濃度偏小的是
A. 容量瓶中原有少量蒸餾水 B. 溶液從燒杯轉移到容量瓶中后沒有洗滌燒杯
C. 定容時俯視液面 D. 滴管加水時,有少量水滴到容量瓶外
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀(K2FeO4)是一種集氧化,吸附,絮凝于一體的新型多功能水處理劑,高鐵酸鹽熱 穩定性差。制備方法有濕法、干法兩種,其原理如下表所示:
濕法的生產工藝如下:

回答下列問題:
(1)K2FeO4 中Fe的化合價 ;實驗室干法制備中選用的儀器是
A.蒸發皿 B.鐵坩堝 C.氧化鋁坩堝 D.陶瓷坩堝
(2)在溫度較高時KOH與Cl2反應生成的是KClO3,寫出在溫度較高時KOH與Cl2反應的化學方程式
___________________;
(3)在溶液 I 中加入KOH 固體的目的是
A.使 KClO3 轉化為 KClO
B.為下一步反應提供堿性的環境
C.KOH 固體溶解放熱,有利于提高反應速率
D.與溶液 I 中過量的 Cl2 繼續反應,生成更多的 KClO
(4)向次氯酸鉀強堿濃溶液中加入 90%的 Fe(NO3)3,發生反應的離子方程式為:
① Fe3++3OH-═Fe(OH)3;② 。
(5)用異丙醇代替蒸餾水洗滌濕產品,除能洗去雜質外,其優點有 。
(6)如何判斷 K2FeO4 晶體已經洗滌干凈 。
(7)高鐵酸鉀(K2FeO4)作為水處理劑的優點之一是能除去懸浮雜質,配平該反應的離子方程式:
____FeO42-+ H2O= Fe(OH)3(膠體)+ O2↑+ ( )
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com