
【題目】某同學胃酸過多,他應該用下列哪種藥品治療 ( )
A. 阿司匹林 B. 青霉素 C. 麻黃素 D. 胃舒平
科目:高中化學 來源: 題型:
【題目】X、Y、Z、P、Q、W、R、T是元素周期表短期中最常見的主族元素,且原子序數依次增大,其相關信息如下表:
元素 | 相關信息 |
X | 其某一種同位素,被用作相對原子質量的標準 |
Y | 其最高價氧化物對應水化物能與其氣態氫化物發生化合反應 |
P | 是短周期中(除稀有氣體外)原子半徑最大的元素 |
Q | 存在質量數為25、中子數為13的核素 |
W | 位于周期表第13列 |
R | 與Z同族, 且最高價氧化物對應水化物的濃溶液常溫下與W 單質會出現鈍化現象 |
(1)W元素位于周期表第________周期______族;T離子的結構示意圖為____________。
(2)將Q、Z、R的簡單離子的半徑從大到小排序___________(用離子符號表示);R、T兩種元素的最高價氧化物對應水化物的酸(或堿)性由強到弱的順序為__________(用化學式表示)。
(3) X、Y、Z三種元素的簡單氫化物中,穩定性最強的化合物的電子式為_________,化合物P2R溶液在空氣中長期放置,會和氧氣反應生成與過氧化鈉的結構相似的物質P2R2,其溶液顯黃色,則P2R2的電子式為______________。
(4)根據下表中的信息,判斷下列化合物固態時的晶體類型(填“離子晶體”……等)。
化合物 | x3Y4 | R2T2 |
主要物理性質 | 硬度可以和金剛石相媲美,熔點>3600℃ | 常溫下是一種橙黃色液體,熔點為-76°C |
晶體類型 | ________ | _________ |
(5)Q的單質能與X、Z形成的某種化合物反應,寫出其化學方程式:______________。
(6)X與Q形成的lmol化合物Q2X3與水反應,生成2molMg(OH)2和1mol某氣態烴,該烴分子中碳氫質量比為9: 1,寫出該氣態烴的結構簡式_______,并寫出Q2X3與水反應的化學方程式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中所含的雜質(括號中是雜質),使用NaOH溶液不能除去的是
A. MgO固體(Al2O3) B. Na2CO3固體(NaHCO3)
C. FeCl2溶液(CuCl2) D. Fe2O3固體(SiO2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向容積為2L的密閉容器通入兩種氣體后發生化學反應,反應中各物質的物質的量變化如圖所示,對該反應的推斷合理的是( )
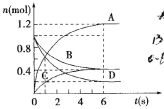
A.該反應的化學方程式為3B+4D=6A+2C
B.反應進行到6s時υ(B)=υ(C)
C.反應進行到6s時,用B表示的平均反應速率為0.05mol·L-1·s-1
D.反應進行到6s時,反應停止了
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在反應KClO3+6HCl(濃)=3Cl2↑+KCl+3H2O中,被還原的氯原子和被氧化的氯原子的個數之比為
A.1:6 B.5:l C.1:5 D.6:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作正確的是
A. 洗凈的量筒和容量瓶不能放進烘箱中烘干
B. 為測定新制氯水的pH,用玻璃棒蘸取液體滴在pH試紙上,再與標準比色卡對照
C. 實驗時,先裝好藥品,再檢查裝置的氣密性
D. 利用澄清石灰水吸收尾氣中的Cl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
(1)配制100 mL 0.10 mol·L-1NaOH標準溶液。
①主要操作步驟:計算→稱量→溶解→___ ___(冷卻后)→洗滌(并將洗滌液移入容量瓶)→___ ___→___ ___→將配制好的溶液倒入試劑瓶中,貼上標簽。
②稱量________g氫氧化鈉固體所需儀器有:托盤天平(帶砝碼、鑷子)、________、________。
(2)取20.00 mL待測鹽酸放入錐形瓶中,并滴加2~3滴酚酞作指示劑,用已配制的NaOH標準溶液進行滴定。重復上述滴定操作2~3次,記錄數據如下。
實驗 | NaOH溶液的濃度(mol·L-1) | 滴定完成時,NaOH溶液滴入的體積(mL) | 待測鹽酸的體積(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定達到終點的標志是___________________________________________________________________。
②根據上述數據,可計算出該鹽酸的濃度約為_____________(保留兩位有效數字)。
③排去堿式滴定管中氣泡的方法應采用如圖所示操作中的________,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液。

④在上述實驗中,下列操作(其他操作正確)會造成測定結果偏高的有________(填字母序號)。
A.滴定終點讀數時俯視
B.酸式滴定管使用前,水洗后未用待測鹽酸潤洗
C.錐形瓶水洗后未干燥
D.稱量NaOH固體中混有Na2CO3固體
E.堿式滴定管尖嘴部分有氣泡,滴定后消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氧化二錳(Mn2O3)在現代工業上位用廣泛,在鋰離子電池的制備中有重要的作用。 用軟錳礦 (主要成分為MnO2)和硫錳礦(主要成分為MnS)制備高純度Mn2O3的工藝流程如圖所示。

(1) 反應①中會生成一種非金屬單質,則該非金屬單質是___________,該反應的還原劑是__________。(填化學式)
(2) 操作X為蒸發濃縮、_____________、過濾、洗滌烘干。在洗滌操作中,常用酒精洗滌MnSO4 H2O晶體,主要目的是______________。
(3) Mn2O3與MnO2類似,加熱時也能與濃鹽酸反應放出Cl2,該反應的離子方程式為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com