
| A. | 強電解質的導電性一定比弱電解質的導電性強 | |
| B. | 溶解度小的物質的導電性一定比溶解度大的物質的導電性弱 | |
| C. | 金屬元素從化合態變為游離態時,該元素一定被還原 | |
| D. | 金屬陽離子得電子多時氧化性強 |
分析 A、水溶液中導電能力與離子的濃度有關,濃度越大導電能力越強,濃度越小導電能力越弱;
B、溶液的導電能力取決于離子濃度的大小;
C、金屬元素無負價;
D、氧化性的強弱取決于得電子的難易.
解答 解:A、溶液導電能力的強弱主要取決于溶液中的離子濃度與每個離子所帶的電量.只有當兩者乘積最大時,溶液導電能力越強.
水溶液中導電能力差的電解質不一定為弱電解質,如硫酸鋇是強電解質,難溶于水,離子濃度小,導電能力弱,故A錯誤;
B、溶液的導電能力取決于離子濃度的大小,與物質的溶解度無關,故B錯誤;
C、金屬元素無負價,故金屬元素在化合態時一定為正價,則變為游離態時一定被還原,故C正確;
D、氧化性的強弱取決于得電子的難易,而非得電子的多少,故D錯誤.
故選C.
點評 本題考查了影響溶液的導電性因素和影響氧化性的因素,根據元素化合價變化來分析解答即可,難度不大,應注意的是溶液的導電能力取決于離子濃度的大小,與物質的溶解度和電解質的強弱無關.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:多選題
 如圖是甲醇燃料電池的結構示意圖.甲醇在催化劑作用下提供質子(H+)和電子,電子經外電路、質子經內電路到達另一極與氧氣反應,電池總反應為:2CH30H+302→2C02+4H20.下列說法正確的是( )
如圖是甲醇燃料電池的結構示意圖.甲醇在催化劑作用下提供質子(H+)和電子,電子經外電路、質子經內電路到達另一極與氧氣反應,電池總反應為:2CH30H+302→2C02+4H20.下列說法正確的是( )| A. | 左電極為電池的負極,a處通入的物質是甲醇 | |
| B. | 右電極為電池的負極,b處通入的物質是空氣 | |
| C. | 負極反應式為:CH30H+H20-6e-→CO2+6H+ | |
| D. | 正極反應式為:02+2H20+4e-→40H- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | 5% H2O2溶液的體積(mL) | 選用試劑 | 選用試劑體積(mL) | 收集V mL O2所需時間(min) |
| ① | 10 | 蒸餾水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 試劑M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
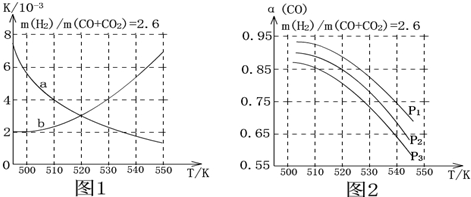
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該反應的化學方程式為:X+Y?2Z | |
| B. | 當反應速率大小關系為:v(X)=v(Y)=2v(Z)時,該反應達到平衡狀態 | |
| C. | 圖a中反應達到平衡時,Y的轉化率為37.5% | |
| D. | 該反應的正反應是放熱反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com