
分析 (1)氫鍵是一種特殊的分子間作用力,非化學鍵,N、O、F元素的電負性較強,對應的氫化物或含氫化合物可形成氫鍵,一般來說,不同非金屬元素之間存在極性共價鍵;同種非金屬元素之間易形成非極性共價鍵;CuSO4•5H2O為配合物,配合物形式為[Cu(H2O)4]SO4•H2O,CH3COONH4為離子化合物,銨根離子中含有配位鍵;
(2)絡合物由內界和外界組成,絡合物溶于水發生電離生成內界離子(絡離子)和外界離子,與AgNO3溶液反應的離子肯定為外界離子,加入NaOH并加熱時兩種溶液都無味,說明NH3在內界;
(3)利用觀察法配平方程式;根據方程式可知,每摩爾硝化甘油分解產生的氣體,由此計算出0.1mol硝化甘油分解產生氣體,根據2.27g硝化甘油分解放出熱量為15.4kJ,可列比例計算4mol硝化甘油分解放出的熱量,結合熱化學方程式書寫方法寫出,根據熱化學方程式,可求出生成1mol氣體放出的熱量.
解答 解:(1)CH3COONH4為離子化合物,銨根離子中氮提供孤對電子,氫離子提供空軌道,存在配位鍵,N-H、C-H、C-O為極性共價鍵,無氫鍵、非極性共價鍵,
CuSO4•5H2O為配合物,配合物形式為[Cu(H2O)4]SO4•H2O,存在離子鍵([Cu(H2O)4]2+、SO42-)、配位鍵((Cu2+、H2O)、氫鍵([Cu(H2O)4]SO4與H2O之間)以及極性共價鍵(不同非金屬元素之間),所以CH3COONH4 不同于CuSO4•5H2O的微粒間作用有氫鍵,
故答案為:a;
(2)絡合物由內界和外界組成,與AgNO3溶液反應的離子肯定為外界離子,第一種CrCl3•6NH3配合物中加入AgNO3溶液能從第一種配合物水溶液中將幾乎所有的氯沉淀為AgCl,說明氯都存在于外界,第二種配合物水溶液中僅能沉淀出相當于組成中含氯量2/3的AgCl,說明氯只有2/3在外界;加入NaOH加熱時兩種溶液都沒有NH3產生,因此兩種配合物中NH3的都在內界,所以兩種配合物的化學式分別為:[Cr(NH3)6]Cl3、[CrCl(NH3)5]Cl2,
故答案為:[Cr(NH3)6]Cl3、[CrCl(NH3)5]Cl2;
(3)硝化甘油(C3H5N3O9)分解時產物為N2、CO2、O2和H2O,配平方程式得:4C3H5N3O9$\frac{\underline{\;\;△\;\;}}{\;}$6N2+12CO2+O2+10H2O;硝化甘油的摩爾質量為227g/mol,
2.27g硝化甘油的物質的量為$\frac{2.27g}{227g/mol}$=0.01mol,放出15.4KJ能量,4mol硝化甘油(C3H5N3O9)分解時放出熱量=$\frac{15.4×4}{0.01}$KJ=6160KJ,
反應的熱化學方程式為:4C3H5N3O9 (l)=6N2(g)+12CO2(g)+O2(g)+10H2O(l)△H=-6160KJ/mol,
2.27g硝化甘油的物質的量為0.01mol,生成氣體$\frac{19}{4}$×0.01=0.0475mol,放出15.4KJ能量,
則生成1mol氣體放出的熱量為:$\frac{15.4KJ}{0.0475}$=324.2KJ,
故答案為:4C3H5N3O9=6N2+12CO2+O2+10H2O;4C3H5N3O9 (l)=6N2(g)+12CO2(g)+O2(g)+10H2O(l)△H=-6160KJ/mol;324.2.
點評 本題考查了配合物的組成及性質、反應熱的計算,明確化學鍵的類型、配合物的電離方式、熱化學方程式的意義是解本題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
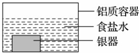 銀制器皿表面日久因生成 Ag2S 而變黑,可進行如下處理:將表面發黑的銀器浸入盛有食鹽水的鋁質容器中(如圖),一段時間后黑色褪去.有關說法正確的是
銀制器皿表面日久因生成 Ag2S 而變黑,可進行如下處理:將表面發黑的銀器浸入盛有食鹽水的鋁質容器中(如圖),一段時間后黑色褪去.有關說法正確的是| A. | 該處理過程中電能轉化為化學能 | B. | 銀器為正極,Ag2S 還原為單質銀 | ||
| C. | 鋁質容器為陽極,其質量變輕 | D. | Ag2S 溶解于食鹽水生成了 AgCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(B2)=4.8 mol/(L•min) | B. | v(A2)=1.5 mol/(L•s) | ||
| C. | v(C)=1.6 mol/(L•s) | D. | v(B2)=1.7 mol/(L•s) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | PH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 由水電離出的C(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 無色溶液中:Cu2+、Al3+、NH4+、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、AlO2-、S2- |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗編號 | 溫度/℃ | H2O2濃度/% | 其它試劑 | 實驗目的 |
| ① | 20 | 5 | 無 | (Ⅰ)實驗①和②探究催化劑對H2O2分解速率的影響; (Ⅱ)實驗②和③探究溫度對該反應速率的影響; (Ⅲ)實驗②和④探究H2O2濃度對該反應速率的影響. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2的電子式: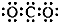 | |
| B. | 質量數為37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的電子式: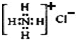 | |
| D. | 原子核內有10個中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
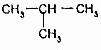 的關系是同系物
的關系是同系物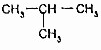 (異丁烷)的關系是同分異構體.
(異丁烷)的關系是同分異構體.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com