
| 實驗編號 | 起始濃度/(mol•L-1) | 反應后溶液的pH | |
| c(HCl) | c(MOH) | ||
| ① | 0.1 | 0.1 | 5 |
| ② | 0.2 | x | 7 |
| ③ | 0.1 | 0.2 | 10 |
| ④ | 0.2 | 0.1 | y |
| A. | 實驗①反應后的溶液中:c(MOH)約為1×10-5 mol•L-1 | |
| B. | 實驗②反應后的溶液中:c(MOH)>c(M+)=c(Cl-)>c(H+)=c(OH-) | |
| C. | 實驗③反應后的溶液中:c(M+)+c(H+)=c(OH-)+c(MOH) | |
| D. | 實驗④反應后的溶液中:c(H+)-c(OH-)-c(MOH)=0.05mol•L-1 |
分析 根據圖知,①等物質的量的HCl和MOH混合,二者恰好反應生成MCl,溶液呈酸性,說明MCl是強酸弱堿鹽,則MOH是弱堿,弱堿離子水解導致溶液呈酸性;
②MCl是強酸弱堿鹽,其水溶液呈酸性,要使混合溶液呈中性,則MOH的物質的量應該稍微大些;
③混合溶液中存在等物質的量濃度的MCl和MOH,MOH的電離程度大于M+水解程度導致溶液呈堿性,溶液中存在電荷守恒和物料守恒,根據電荷守恒和物料守恒判斷;
④二者混合后,溶液中存在等物質的量濃度的MCl和HCl,溶液呈酸性,溶液中存在物料守恒和電荷守恒,根據物料守恒和電荷守恒判斷.
解答 解:A.根據圖知,①等物質的量的HCl和MOH混合,二者恰好反應生成MCl,溶液呈酸性,說明MCl是強酸弱堿鹽,則MOH是弱堿,弱堿離子水解導致溶液呈酸性,水解方程式為M++H2O?MOH+H+,根據方程式知,溶液中c(MOH)≈c(H+)=1×10-5 mol•L-1,故A正確;
B.②MCl是強酸弱堿鹽,其水溶液呈酸性,要使混合溶液呈中性,則MOH的物質的量應該稍微大些,但溶液中c(MOH)較小,所以c(M+)=c(Cl-)>c(MOH),故B錯誤;
C.③混合溶液中存在等物質的量濃度的MCl和MOH,MOH的電離程度大于M+水解程度導致溶液呈堿性,溶液中存在電荷守恒和物料守恒,根據電荷守恒得c(M+)+c(H+)=c(OH-)+c(Cl-),根據物料守恒得2c(Cl-)=c(M+)+c(MOH),所以得c(M+)+2c(H+)=2c(OH-)+c(MOH),故C錯誤;
D.④二者混合后,溶液中存在等物質的量濃度的MCl和HCl,溶液呈酸性,根據電荷守恒得c(M+)+c(H+)=c(OH-)+c(Cl-),根據物料守恒得c(Cl-)=2c(M+)+2c(MOH),所以得c(H+)=c(OH-)+c(M+)+2c(MOH),則c(H+)-c(OH-)-c(MOH)=c(M+)+c(MOH)=0.05mol/L,故D正確;
故選AD.
點評 本題考查離子濃度大小比較,明確溶液中的溶質及溶液酸堿性是解本題關鍵,難點是靈活運用電荷守恒和物料守恒,易錯選項是D.


科目:高中化學 來源: 題型:選擇題
| A. | 同二氧化碳一樣,二氧化硅分子是由一個硅原子和兩個氧原子構成的 | |
| B. | 通常狀況下,二氧化碳為氣態,二氧化硅為固體 | |
| C. | SiO2同CO2一樣也能與CaO反應生成鹽 | |
| D. | SiO2僅用來表示二氧化硅的組成,其基本結構單元為正四面體,不僅存在于二氧化硅晶體中,而且存在于所有硅酸鹽礦石中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

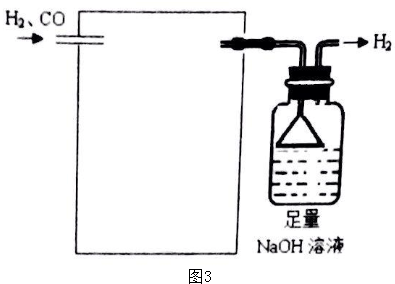
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 是直鏈烴,但分子中碳原子不在一條直線上 | |
| B. | 在光照條件下能夠與氯氣發生取代反應 | |
| C. | 丙烷比其同分異構體丁烷易汽化,耗氧量少 | |
| D. | 燃燒時主要是將化學能轉變為熱能和光能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,48g O3含有的氧原子數為3NA | |
| B. | 17g的OH-離子中含有的電子數為0.1NA | |
| C. | 常溫常壓下,11.2L氧氣中所含有的原子數為NA | |
| D. | 2.4g金屬鎂變為鎂離子時失去的電子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某化學興趣小組用甲、乙兩套裝置(如圖所示)進行甲酸(HCOOH)與甲醇(CH3OH)酯化反應的實驗,回答以下問題:
某化學興趣小組用甲、乙兩套裝置(如圖所示)進行甲酸(HCOOH)與甲醇(CH3OH)酯化反應的實驗,回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCH3 | D. | CH3C≡CH |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com