
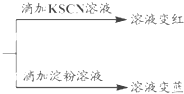
分析 (1)實驗I中Fe(OH)2Cl與鹽酸反應生成氯化鐵和水,過量的鐵會和氯化鐵反應生成氯化亞鐵;
(2)10mL•mol/LFeCl2溶液(含HCl)滴入KSCN溶液無變化,加入過氧化氫溶液變紅色,過氧化氫氧化亞鐵離子為鐵離子;
(3)10mL 0.1mol/LKI溶液,滴入6滴0.1mol/LFeCl3溶液得到黃色溶液,KI溶液過量,滴加KSCN溶液會使溶液變紅色證明含鐵離子,滴入淀粉溶液變藍色,證明含有碘單質,同時含鐵離子和碘離子說明反應為可逆反應;
(4)用6mL CCl4分三次洗滌后萃取碘單質,使得化學平衡正向進行,鐵離子變化為亞鐵離子,Fe3+用KSCN檢驗時最低顯色濃度為1×10-5mol/L,據此分析;
解答 解:(1)實驗I中Fe(OH)2Cl與鹽酸反應生成氯化鐵和水,過量的鐵會和氯化鐵反應生成氯化亞鐵,反應的離子方程式為:Fe(OH)2Cl+2H+=Fe3++2H2O+Cl-,加入稍過量Fe粉的作用是將鐵離子還原為亞鐵離子,2Fe3++Fe=3Fe2+,防止Fe2+氧化變質,
故答案為:Fe(OH)2Cl+2H+=Fe3++2H2O+Cl-,將Fe3+還原為Fe2+,防止Fe2+氧化變質;
(2)10mL•mol/LFeCl2溶液(含HCl)滴入KSCN溶液無變化,加入過氧化氫溶液變紅色,過氧化氫氧化亞鐵離子為鐵離子,鐵離子結合硫氰酸根離子生成血紅色溶液,反應的離子方程式為:2Fe2++2H++H2O2=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3,
故答案為:2Fe2++2H++H2O2=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3;
(3)10mL 0.1mol/LKI溶液,滴入6滴0.1mol/LFeCl3溶液得到黃色溶液,KI溶液過量,滴加KSCN溶液會使溶液變紅色證明含鐵離子,滴入淀粉溶液變藍色,證明含有碘單質,同時含鐵離子和碘離子說明反應為可逆反應,推測黃色溶液中含有的溶質微粒有K+、Cl-和Fe3+、Fe2+、I2、I-,Fe3+與I-反應為可逆反應,反應的離子方程式為:2Fe3++2I-?2Fe2++I2,
故答案為:Fe3+、Fe2+、I2、I-,2Fe3++2I-?2Fe2++I2;
(4)某同學取2mL黃色溶液用6mL CCl4分三次洗滌后,再往水層中滴加KSCN溶液,發現溶液未變紅.洗滌時是利用分液漏斗裝置,所用的主要玻璃儀器是分液漏斗,
6mL CCl4分三次洗滌后萃取碘單質,2Fe3++2I-?2Fe2++I2,使得化學平衡正向進行,鐵離子變化為亞鐵離子,Fe3+用KSCN檢驗時最低顯色濃度為1×10-5mol/L,當鐵離子濃度低于此濃度無法顯色,
故答案為:I2被萃取至CCl4中,平衡向生成亞鐵離子的方向進行,多次萃取后鐵離子濃度低于1×10-5mol/L,無法顯色.
點評 本題考查了物質性質、離子檢驗、萃取分液的理解應用,實驗現象的判斷,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:實驗題
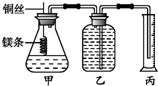 某研究性學習小組欲測定室溫下(25℃、101kPa)的氣體摩爾體積,請回答以下問題.該小組設計的簡易實驗裝置如圖所示:
某研究性學習小組欲測定室溫下(25℃、101kPa)的氣體摩爾體積,請回答以下問題.該小組設計的簡易實驗裝置如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳氫化合物的通式為CnH2n+2 | |
| B. | 燃燒產物為CO2和H2O的化合物一定是碳氫化合物 | |
| C. | 碳原子間以單鍵相連的烴是烷烴 | |
| D. | 烷烴分子的相對分子質量一定是偶數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 摩爾表示物質的質量的單位 | B. | 16gO2含有0.5mol O2分子 | ||
| C. | 2gH2的體積約為22.4L | D. | 物質的摩爾質量等于其式量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石英玻璃、分子篩的主要成分是硅酸鹽 | |
| B. | 分散系可分為溶液、濁液和膠體,濁液的分散質粒子大小介于溶液和膠體之間 | |
| C. | 鐵在氧氣中燃燒生成氧化鐵,鎂在空氣中燃燒生成氧化鎂、氮化鎂 | |
| D. | 針對埃博拉病毒擴散情況,可選用含氯消毒劑對疫區可能的污染區域進行消毒預防 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
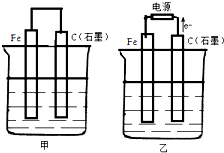 如圖甲、乙是電化學實驗裝置.
如圖甲、乙是電化學實驗裝置.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
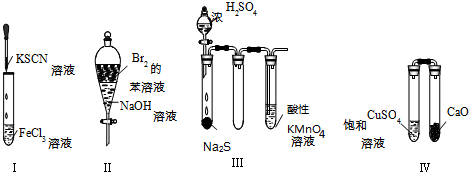
| A. | 實驗Ⅰ:試管中溶液顏色變為紅色 | |
| B. | 實驗Ⅱ:振蕩后靜置,上層溶液顏色保持不變 | |
| C. | 實驗Ⅲ:酸性KMnO4溶液中出現氣泡,但顏色不會褪去 | |
| D. | 實驗Ⅳ:放置一段時間后,飽和CuSO4溶液中出現藍色晶體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com