
(10分)實驗室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題
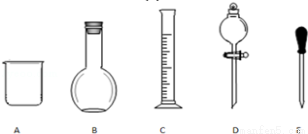
(1)在如圖所示儀器中,配制上述溶液肯定不需要的是 (填序號),除圖中已有儀器外,配制上述溶液還需要的玻璃儀器是 。
(2)在容量瓶的使用方法中,下列操作不正確的是 (填序號)
A.使用容量瓶前檢驗是否漏水
B.配制NaOH溶液時,把稱好的NaOH固體用紙條小心倒入容量瓶中,緩慢加水至接近刻度線1~2cm處,用膠頭滴管加蒸餾水至刻度線
C.配制H2SO4溶液時,容量瓶用蒸餾水洗凈后,還要用0.5mol/L H2SO4溶液潤洗,方可使用
D.蓋好瓶塞,用食指頂住瓶塞,另一只手托住瓶底,把容量瓶反復倒轉多次,搖勻
(3)根據計算用托盤天平稱取的NaOH固體質量為 g。
(4)根據計算得知,需用量筒量取質量分數為98%、密度為1.84g/cm3的濃硫酸的體積為 mL(保留1位小數)。
(5)配制硫酸溶液過程中,下列操作會引起結果偏高的是 (填序號)
A.未洗滌燒杯、玻璃棒
B.未冷卻至室溫就轉移到容量瓶定容
C.定容時仰俯視視刻度線.
 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源:2016屆遼寧省五校協作體高三上學期期初考試化學試卷(解析版) 題型:填空題
【化學——選修3:物質結構與性質】(15分)目前半導體生產展開了一場“銅芯片”革命——在硅芯片上用銅代替鋁布線,古老的金屬銅在現代科技應用上取得了突破,用黃銅礦(主要成分為CuFeS2)生產粗銅,其反應原理如下:
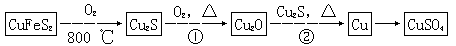
(1)基態銅原子的外圍電子排布式為__________,硫、氧元素相比,第一電離能較大的元素是________(填元素符號)。
(2)反應①、②中均生成有相同的氣體分子,該分子的中心原子雜化類型是________,其立體結構是_______。
(3)某學生用硫酸銅溶液與氨水做了一組實驗:CuSO4溶液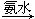 藍色沉淀
藍色沉淀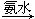 沉淀溶解,得到深藍色透明溶液。寫出藍色沉淀溶于氨水的離子方程式_____________;深藍色透明溶液中的陽離子(不考慮H+)內存在的全部化學鍵類型有 。
沉淀溶解,得到深藍色透明溶液。寫出藍色沉淀溶于氨水的離子方程式_____________;深藍色透明溶液中的陽離子(不考慮H+)內存在的全部化學鍵類型有 。
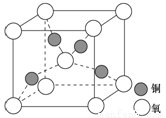
(4)銅是第四周期最重要的過渡元素之一,其單質及化合物具有廣泛用途,銅晶體中銅原子堆積模型為_____________;銅的某種氧化物晶胞結構如圖所示,若該晶體的密度為d g/cm3,阿伏加德羅常數的值為NA,則該晶胞中銅原子與氧原子之間的距離為________pm。((用含d和NA的式子表示)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省高一上學期第一次月考化學試卷(解析版) 題型:選擇題
用NA表示阿伏德羅常數,下列敘述正確的是
A.標準狀況下,1.12 LH2和O2的混合氣體含有的原子數為0.1NA
B.標準狀況下,22.4 L CCl4含有的分子數為 NA
C.通常狀況下,NA 個CO2分子占有的體積為22.4 L
D.物質的量濃度為0.5 mol/L的MgCl2溶液中,含有Cl- 個數為 NA
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省益陽市高一9月月考化學試卷(解析版) 題型:選擇題
同溫同壓下,甲容器中的NH3和乙容器中的CH4所含的原子總數相同,則甲容器與乙容器的體積之比為
A.1:1 B.2:1 C.3:4 D.5:4
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省普寧市高一上學期第一次月考化學試卷(解析版) 題型:選擇題
只用下列試劑中的一種就能鑒別Ba(NO3)2、Na2CO3、K2SO4三種溶液,則該試劑是
A.KNO3溶液 B.稀H2SO4 C.NaOH溶液 D.Na2SO4溶液
查看答案和解析>>
科目:高中化學 來源:2016屆四川省高三9月月考化學試卷(解析版) 題型:選擇題
設NA代表阿伏加德羅常數的數值,則下列說法正確的是
A.1.8 g D2O含有NA個中子
B.用5 mL 3 mol/L FeCl3溶液制成的氫氧化鐵膠體中所含膠粒數為0.015 NA
C.在Na2O2與CO2的反應中,每轉移NA個電子時,消耗22.4 L的CO2
D.25℃時,7 g C2H4和C3H6的混合氣體中,含有NA個C﹣H鍵
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省宿遷市三校高三9月學情調研化學試卷(解析版) 題型:填空題
(10分)常溫下,將某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等體積混合,兩種溶液的物質的量濃度和混合溶液的pH如表所示:
實驗 編號 | HA的物質的量 濃度(mol·L-1) | NaOH的物質的量 濃度(mol·L-1) | 混合后溶 液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)從甲組情況分析,從a值大小如何判斷HA是強酸還是弱酸?_________________。
(2)乙組混合溶液中c(A-)和c(Na+)的大小關系是_______。
A.前者大 B.后者大 C.二者相等 D.無法判斷
(3)從丙組實驗結果分析,該混合溶液中離子濃度由大到小的順序是 。
(4)分析丁組實驗數據,寫出該混合溶液中下列算式的精確結果(列式):
c(Na+)-c(A-)=_______ mol·L-1。
(5)某二元酸(化學式用H2B表示)在水中的電離方程式是:H2B===H++HB-
HB- H++B2-。
H++B2-。
在0.1 mol·L-1的Na2B溶液中,下列粒子濃度關系式正確的是 。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c (H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省高三第一次月考化學試卷(解析版) 題型:選擇題
向一盛有22.4L(標準狀況下)CO2和CO混合氣體的密閉容器中投入1molNa2O2固體,用間斷的電火花引發至充分反應,下列對反應完全后容器里剩余固體的敘述正確的是
A.1mol Na2CO3
B.0.5 mol Na2CO3,0.5mol Na2O2
C.0.25 mol Na2CO3,0.75 mol Na2O2
D.0.75 mol Na2CO3,0.25 mol Na2O2
查看答案和解析>>
科目:高中化學 來源:2016屆河南省濮陽市心高三上第一次市統摸底化學試卷(解析版) 題型:選擇題
室溫下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的變化曲線如圖所示。下列說法正確的是
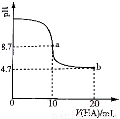
A.a點所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b兩點所示溶液中水的電離程度相同
C.b點所示溶液中c(A—)> c(HA)
D.pH=7時,c(Na+)= c(A—)+ c(HA)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com