
| A. | 標準狀況下,11.2L苯含有的分子數為0.5NA | |
| B. | 3.2gCH4含有的化學鍵數為0.4NA | |
| C. | 足量的O2與1molNa充分反應,轉移的電子數為NA | |
| D. | 25℃時,1.0LpH=13的Ba(0H)2溶液中含有的0H-數為0.2NA |
分析 A.標準狀況下,苯不是氣體;
B.根據$\frac{m}{M}=n$計算甲烷的物質的量,每個甲烷分子含有4條C-H鍵;
C.根據Na$\stackrel{-e-}{→}$Na+計算;
D.pH=13的溶液中氫氧根離子濃度為0.1mol/L,1L該溶液中含有0.1mol氫氧根離子.
解答 解:A.標準狀況下,苯不是氣體,不能帶入n=$\frac{V}{{V}_{m}}$計算,故A錯誤;
B.n(CH4)=$\frac{3.2g}{16g/mol}$=0.2mol,含有0.2NA個分子,每個甲烷分子含有4條C-H鍵,因此化學鍵數為0.8NA,故B錯誤;
C.鈉與氧氣反應時Na$\stackrel{-e-}{→}$Na+,1molNa失去NA個電子,因此轉移電子數為NA,故C正確;
D.常溫下,1.0L pH=13的Ba(OH)2溶液中氫氧根離子濃度為0.1mol/L,1L該溶液中含有0.1mol氫氧根離子,含有的OH-數目為0.1NA,故D錯誤;
故選C.
點評 本題考查了阿伏伽德羅常數的綜合應用,題目難度中等,明確標準狀況下氣體摩爾體積的使用條件、轉移電子數以及pH的計算方法為解答關鍵.


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:選擇題

| A. | 2 mol H2(g)與1 mol O2(g)所具有的總能量比2 mol H2O(g) 所具有的總能量低 | |
| B. | 氫氣的燃燒熱為△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)時,斷鍵吸收的能量小于成鍵放出的能量 | |
| D. | 液態水分解的熱化學方程式為:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素代號 | 部分特征 |
| A | 單質為相同條件下密度最小的氣體 |
| B | 基態原子最外層電子排布式為nsnnpn |
| C | 與元素E處于同一周期且電負性僅次于E |
| D | 位于第三周期且第一電離能最小 |
| E | 雙原子分子單質在標準狀況下密度為1.4285g/L |
| F | 生活中常用的金屬,在空氣中表面通常形成一層致密的氧化膜 |
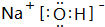 ;F的氧化物既可以和強酸反應也可以和強堿反應,試寫出其氧化物與NaOH溶液反應的離子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和強酸反應也可以和強堿反應,試寫出其氧化物與NaOH溶液反應的離子方程式Al2O3+2OH-=2AlO2-+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 納米銅比納米鐵金屬活動性更強 | |
| B. | 納米銅在反應中可能作氧化劑 | |
| C. | 納米TiO2在不同溶劑中均形成了膠體 | |
| D. | 納米TiO2有很強的氯化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
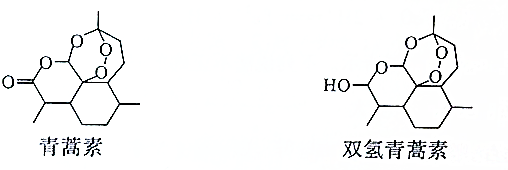
| A. | 雙氫青篙素屬于脂類物質 | |
| B. | 青蒿素的分子式為C15H21O5 | |
| C. | 青蒿素環上的一氯取代物有11種 | |
| D. | 青蒿素通過加成反應可以轉化為雙氫青蒿素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測溶液A的體積(mL) | KMnO4標準溶液的體積 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
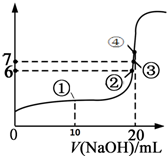 25℃時,向20mL 0.1mol/L的氫氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加過程中混合溶液的pH變化曲線如圖所示,回答下列問題:
25℃時,向20mL 0.1mol/L的氫氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加過程中混合溶液的pH變化曲線如圖所示,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | HA的濃度(mol/L) | NaOH的濃度(mol/L) | 混合溶液的PH |
| 甲 | 0.2 | 0.2 | PH=a |
| 乙 | C1 | 0.2 | PH=7 |
| 丙 | 0.1 | 0.1 | PH=10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
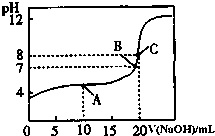 室溫下:(1)pH=13的CH3COONa溶液加水稀釋100倍后,pH>11(填“>”“=”或“<”);
室溫下:(1)pH=13的CH3COONa溶液加水稀釋100倍后,pH>11(填“>”“=”或“<”);查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com