
| A. | 2.24L | B. | 4.48L | C. | 5.6L | D. | 11.2L |
分析 由質量守恒定律可知E的質量,E的密度是H2密度的15.5倍,則相對分子質量為31,可計算物質的量濃度,進而根據V=nVm,計算體積.
解答 解:已知10.2g A與12.8g B完全反應,生成9.6g C和7.2g D及另一氣體E,
m(E)=10.2g+12.8g-9.6g-7.2g=6.2g,
E的密度是H2密度的15.5倍,則相對分子質量為31,
n(E)=$\frac{6.2g}{31g/mol}$=0.2mol,
V(E)=0.2mol×22.4L/mol=4.48L.
故選B.
點評 本題考查化學方程式的計算,為高頻考點,側重于學生的分析、計算能力的考查,注意從質量守恒的角度解答,把握相關計算公式.


科目:高中化學 來源: 題型:選擇題
| A. | 20℃時,1mol SO2的體積一定大于22.4L | |
| B. | 常溫常壓下,1mol CO2與18 g H2O所含有的原子總數均為3 NA | |
| C. | 1mol/LNaCl溶液表示1L水中含有NaCl 58.5g | |
| D. | 標準狀況下,11.2L NO與5.6 L O2形成的混合氣體中含有的分子數為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
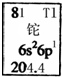
| A. | 鉈元素的質量數是81 | B. | 鉈原子的電子數為3 | ||
| C. | 鉈原子的相對原子質量是204.4 | D. | 鉈的金屬性比鋁的金屬性強 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬單質可能與非金屬、酸、鹽溶液發生反應 | |
| B. | 酸性氧化物能與堿反應且大部分能與水化合成酸 | |
| C. | 堿性氧化物能與酸反應且都能與水化合成堿 | |
| D. | 酸能與金屬、堿性氧化物、堿、某些鹽溶液發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KNO3 K2SO4 K2CO3 K3PO4 | B. | NaOH KOH Ba(OH)2 Ca(OH)2 | ||
| C. | Na2O K2O CaO CO2 | D. | HNO3 H2SO4 H3PO4 HClO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 儀器標號 | 1 | 2 | 3 | 4 | 5 |
| 試劑標號 | E | AFG | C | G | I |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 半導體生產中常需要控制摻雜,以保證控制電阻率,三氯化磷(PCl3)中一種重要的摻雜劑.實驗室要用黃磷(白磷)與干燥的Cl2模擬工業生產制取PCl3,裝置如下圖所示:(部分夾持裝置略去)
半導體生產中常需要控制摻雜,以保證控制電阻率,三氯化磷(PCl3)中一種重要的摻雜劑.實驗室要用黃磷(白磷)與干燥的Cl2模擬工業生產制取PCl3,裝置如下圖所示:(部分夾持裝置略去)| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| PCl5 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
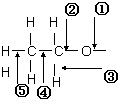 乙醇分子中各化學鍵如圖所示:
乙醇分子中各化學鍵如圖所示:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com