
【題目】下列氣態氫化物中,最不穩定的是( )
A. HI B. HBr C. HCl D. HF
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】有甲、乙兩位同學均想利用原電池反應檢測金屬的活動性順序,兩人均用鎂片和鋁片作電極,但甲同學將電極放入6 mol·L-1的H2SO4溶液中,乙同學將電極放入6 mol·L-1的NaOH溶液中,如圖所示。
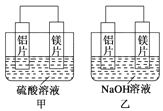
(1)寫出甲中正極的電極反應式___________________。
(2)乙中總反應的離子方程式:________________________。
(3)如果甲與乙同學均認為“構成原電池的電極材料如果都是金屬,則構成負極材料的金屬應比構成正極材料的金屬活潑”,則甲會判斷出 活動性更強,而乙會判斷出_____________活動性更強。(填寫元素符號)
(4)由此實驗得出的下列結論中,正確的有______________。
A.利用原電池反應判斷金屬活動性順序時應注意選擇合適的介質
B.鎂的金屬性不一定比鋁的金屬性強
C.該實驗說明金屬活動性順序表已過時,沒有實用價值了
D.該實驗說明化學研究對象復雜、反應受條件影響較大,應具體問題具體分析
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列說法正確的是( )
A.只有硫酸銅作氧化劑
B.SO![]() 既不是氧化產物又不是還原產物
既不是氧化產物又不是還原產物
C.被氧化的硫與被還原的硫的質量比為3∶7
D.1 mol硫酸銅可以氧化5/7 mol的硫原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】臭氧在煙氣脫硝中的反應為2NO2(g)+O2(g)![]() N2O5(g)+O2(g)。若此反應在恒容密閉容器中進行,相關圖象如下列選項,其中對應分析結論正確的是( )
N2O5(g)+O2(g)。若此反應在恒容密閉容器中進行,相關圖象如下列選項,其中對應分析結論正確的是( )
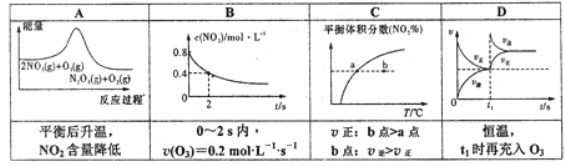
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學們對SO2與漂粉精、過氧化鈉的反應進行實驗探究:
【實驗I】SO2與漂粉精反應。
操作 | 現象 |
取4g 漂粉精固體,加入100mL 水 | 部分固體溶解,溶液略有顏色 |
過濾,測漂粉精溶液的pH | pH 試紙先變藍(約為12),后褪色 |
| 1.液面上方出現白霧; 2.稍后,出現渾濁,溶液變為黃綠色; 3.稍后,產生大量白色沉淀,黃綠色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反應中氧化劑與還原劑的物質的量之比為__________。
(2)pH試紙顏色的變化說明漂粉精溶液具有的性質是____________。
(3)興趣小組將A中產生的白霧引出導入硝酸酸化的AgN03溶液中,有沉淀產生,據此判斷白霧成分為HCl小液滴,該結論合理嗎?____________請說明理由____________________。
(4)現象2中溶液變為黃綠色的原因是:隨溶液酸性的增強,漂粉精的有效成分和Cl-發生反應。該反應的離子方程式為______________。
(5)①將A瓶中混合物過濾、洗滌,得到沉淀X,X的成分是____________(填化學式);
② 用離子方程式解釋現象3中黃綠色褪去的原因____________________。
【實驗II】SO2與過氧化鈉反應。將一定量(過量)SO2充入注射器X中,硬質玻璃管Y中加入少量過氧化鈉,兩端用夾子K1、K2夾好。在室溫下按圖示裝置進行實驗,請填寫空白。
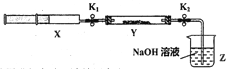
操作步驟 | 實驗現象 | 解釋原因 |
打開K1,推動注射器活塞,使X中的氣體緩慢通入Y管中(假設充分反應) | (1)_______ | (2)反應的化學方程式:_________________ |
將注射器活塞退回原處并固定,待裝置恢復到室溫,打開K2 | (3)________ | (4)不用解釋 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現用98%的濃H2SO4(ρ="1.84" g/cm3)配制成濃度為1.0mol/L的稀硫酸250 mL。
(1)現有主要儀器:A量筒 B燒杯 C玻璃棒 D膠頭滴管 還缺少的儀器_______________;
(2)請將下列操作序號按正確順序填在橫線上:
A.用量筒量取濃H2SO4
B.反復顛倒搖勻
C.用膠頭滴管加水至刻度
D.洗滌燒杯、玻璃棒2-3次
E.稀釋濃H2SO4
F.冷卻后將溶液轉入容量瓶
其操作正確順序為__________________;
(3)下列操作中,容量瓶所不具備的功能有________(填序號);
A.配制一定體積準確濃度的標準溶液
B.量取一定體積的液體
C.測量容量瓶規格以下的任意體積的液體
D.貯存溶液
E.用來加熱和溶解固體溶質
(4)簡要回答下列問題
①所需濃H2SO4的體積為___________mL;
②將濃H2SO4沿燒杯內壁慢慢注入盛水的燒杯中,不斷攪拌,若攪拌過程中有液體濺出,會使最終結果_________ (填“偏高”、“偏低”或“無影響”,下同);若將量筒洗滌轉移到容量瓶會使最終結果_________ ;定容時水加多后用滴管吸出會使結果_________;
(5)該濃硫酸與等質量的水混合所得溶液的物質的量濃度________9.2 mol/L (填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向絕熱恒容密閉容器中通入SO2和NO2,一定條件下使反應SO2(g)+NO2(g)![]() SO3(g)+NO(g)達到平衡,正反應速率隨時間變化的示意圖如下所示。由圖可得出的正確結論是
SO3(g)+NO(g)達到平衡,正反應速率隨時間變化的示意圖如下所示。由圖可得出的正確結論是
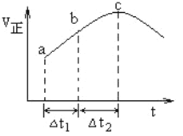
A. 反應在c點達到平衡狀態
B. 反應物濃度:a點小于b點
C. 反應物的總能量低于生成物的總能量
D. △t1=△t2時,SO2的轉化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 同物質的量的濃度的三種溶液:Na2SO4、MgSO4、Al2(SO4)3,其體積比為3∶2∶1,則SO![]() 濃度之比為1∶1∶3
濃度之比為1∶1∶3
B. 將10 mL 1 mol/L H2SO4稀釋成0.1 mol/L的H2SO4,可向該溶液中加入100 mL水
C. 將1 mol/L的NaCl溶液和0.5 mol/L的BaCl2溶液等體積混合后,不考慮溶液體積變化c(Cl-)=0.75 mol/L
D. 50 g濃度為c mol/L,密度為ρg·cm-3的氨水(ρ<1)中加入一定量的水(ρ=1g·cm-3)稀釋成0.5c mol/L,則加入水的體積應小于50 mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵電池是一種新型可充電電池,與普通高能電池相比,該電池能長時間保持穩定的放電電壓。高鐵電池的總反應為 3Zn + 2K2FeO4+ 8H2O![]() 3Zn(OH)2+ 2Fe(OH)3+ 4KOH下列敘述不正確的是( )
3Zn(OH)2+ 2Fe(OH)3+ 4KOH下列敘述不正確的是( )
A. 放電時負極反應為:Zn-2e- +2OH-= Zn(OH)2
B. 充電時陽極反應為:Fe(OH)3-3e-+ 5 OH-= FeO42-+ 4H2O
C. 放電時每轉移3 mol電子,正極有1mol K2FeO4被氧化
D. 放電時正極附近溶液的堿性增強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com