
【題目】某化學興趣小組的同學們對SO2與漂粉精、過氧化鈉的反應進行實驗探究:
【實驗I】SO2與漂粉精反應。
操作 | 現象 |
取4g 漂粉精固體,加入100mL 水 | 部分固體溶解,溶液略有顏色 |
過濾,測漂粉精溶液的pH | pH 試紙先變藍(約為12),后褪色 |
| 1.液面上方出現白霧; 2.稍后,出現渾濁,溶液變為黃綠色; 3.稍后,產生大量白色沉淀,黃綠色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反應中氧化劑與還原劑的物質的量之比為__________。
(2)pH試紙顏色的變化說明漂粉精溶液具有的性質是____________。
(3)興趣小組將A中產生的白霧引出導入硝酸酸化的AgN03溶液中,有沉淀產生,據此判斷白霧成分為HCl小液滴,該結論合理嗎?____________請說明理由____________________。
(4)現象2中溶液變為黃綠色的原因是:隨溶液酸性的增強,漂粉精的有效成分和Cl-發生反應。該反應的離子方程式為______________。
(5)①將A瓶中混合物過濾、洗滌,得到沉淀X,X的成分是____________(填化學式);
② 用離子方程式解釋現象3中黃綠色褪去的原因____________________。
【實驗II】SO2與過氧化鈉反應。將一定量(過量)SO2充入注射器X中,硬質玻璃管Y中加入少量過氧化鈉,兩端用夾子K1、K2夾好。在室溫下按圖示裝置進行實驗,請填寫空白。
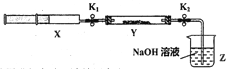
操作步驟 | 實驗現象 | 解釋原因 |
打開K1,推動注射器活塞,使X中的氣體緩慢通入Y管中(假設充分反應) | (1)_______ | (2)反應的化學方程式:_________________ |
將注射器活塞退回原處并固定,待裝置恢復到室溫,打開K2 | (3)________ | (4)不用解釋 |
【答案】【實驗I】(1)1:1;(2)堿性、漂白性;
(3)不合理(1分);因為白霧中可能含有少量Cl2和SO2,也容易產生沉淀(1分);
(4)ClO-+Cl-+2H+=2H2O+Cl2↑;
(5)①CaSO4(1分);②SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+(或SO2+Cl2+2H2O=SO42-+2Cl-+4H+)
【實驗II】(1)淺黃色固體變為白色;(2)SO2+Na2O2=Na2SO4;
(3)Z中NaOH溶液倒吸入Y管中
【解析】
試題分析:(1)Cl2和Ca(OH)2制取漂粉精反應的方程式為2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,氯氣既是氧化劑,也是還原劑,氯化鈣是還原產物,次氯酸鈣是氧化產物,因此氧化劑與還原劑的物質的量之比為1:1;
(2)pH 試紙先變藍(約為12),后褪色,說明漂粉精溶液具有的性質是堿性、漂白性;
(3)由于白霧中可能含有少量Cl2和SO2,導入硝酸酸化的AgNO3溶液中,也容易產生沉淀,所以結論不合理;
(4)現象2中溶液變為黃綠色,說明有氯氣產生,這是由于隨溶液酸性的增強,漂粉精的有效成分和Cl-發生反應,該反應的離子方程式為ClO-+Cl-+2H+=2H2O+Cl2↑;
(5)①SO2被氧化生成硫酸,進而生成硫酸鈣沉淀,因此將A瓶中混合物過濾、洗滌,得到的沉淀為CaSO4;
②由于氯氣能把SO2氧化為硫酸,進而產生硫酸鈣沉淀,所以黃綠色褪去,反應的離子方程式為SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+。
【實驗II】過氧化鈉具有強氧化性,能把SO2氧化為硫酸鈉,因此實驗現象是淺黃色固體變為白色,反應的化學方程式為SO2+Na2O2=Na2SO4;將注射器活塞退回原處并固定,待裝置恢復到室溫,打開K2后由于SO2被吸收,壓強減小,從而產生倒吸現象,所以實驗現象為Z中NaOH溶液倒吸入Y管中。


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】為了將混有K2SO4、MgSO4的KNO3固體提純,并制得純凈的KNO3溶液,某同學設計如下實驗方案:

(1)操作①為____________;
(2)操作②~④加入的試劑可以為 。
(3)如何判斷SO![]() 已除盡,簡述實驗操作 ;
已除盡,簡述實驗操作 ;
(4)實驗過程中產生的多次沉淀_________(填“需要”或“不需要”)多次過濾,理由 。
(5)該同學設計的實驗方案____________(填“合理”或“不合理”),理由是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于離子鍵、共價鍵的各種敘述中,下列說法中正確的是( )
A.在離子化合物里,只存在離子鍵,沒有共價鍵
B.非極性鍵只存在于雙原子的單質分子中
C.任何物質里都含有化學鍵
D.在共價化合物分子內,一定不存在離子鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.同溫同壓下,相同數目的分子必具有相同的體積
B.等質量的O2和H2的物質的量之比為16∶1
C.不同的氣體若體積不等,則它們所含的分子數一定不等
D.同溫同體積下,兩種氣體的物質的量之比等于壓強之比
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】加成反應也是有機化學中的一類重要的反應類型,下列各組物質中不能全部發生加成反應的是
A.乙烷、乙烯 B.乙烯、乙炔
C.氯乙烯、溴乙烯 D.順-2-丁烯、反-2-丁烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液可能含有Na+、K+、Mg2+、Cu2+等陽離子及MnO![]() 、SiO
、SiO![]() 、AlO
、AlO![]() 、CO
、CO![]() 、HCO
、HCO![]() 、SO
、SO![]() 、Cl-等陰離子,已知:①該溶液呈無色;②經測定溶液的pH=12;③取少量溶液,加入足量100 mL 2 mol·L-1稀鹽酸進行酸化,有白色沉淀生成,還得到一種無色無味的氣體,該氣體使澄清石灰水(足量)變渾濁。對酸化后的溶液過濾,得到濾液甲。
、Cl-等陰離子,已知:①該溶液呈無色;②經測定溶液的pH=12;③取少量溶液,加入足量100 mL 2 mol·L-1稀鹽酸進行酸化,有白色沉淀生成,還得到一種無色無味的氣體,該氣體使澄清石灰水(足量)變渾濁。對酸化后的溶液過濾,得到濾液甲。
(1)由①②③可判斷:原溶液中一定不存在的離子是_____________,一定存在的離子是_____________。
(2)將濾液甲分成兩等份,一份中逐滴加入氨水、最終有白色膠狀沉淀,說明原溶液中一定有_____________(填離子符號),剛開始加入氨水時,沒有沉淀產生,原因是____________________(用離子方程式表示);另一份中加入足量的Ba(NO3)2溶液,有白色沉淀生成,說明原溶液中一定有_____________(填離子符號),過濾得到濾液乙。
(3)往濾液乙中加入足量的AgNO3溶液,過濾、洗滌、干燥得固體26.5 g,則原溶液中是否有Cl-?_____________(填“是”或“否”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于元素及其化合物的說法不正確的是( )
A.Fe在一定條件下可與濃鹽酸、稀硫酸、濃硝酸等劇烈反應
B.Al、Cl2均能和NaOH溶液發生氧化還原反應,且兩單質的作用不相同
C.在稀硫酸中加入銅粉,銅粉不溶解,若再繼續加入KNO3固體,銅粉會溶解
D.金屬單質Na、Mg、Fe在一定條件下與水反應都生成H2和相應的堿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質用途的說法錯誤的是
A.可用鋁槽密閉盛裝濃硫酸
B.工業上利用蛋白質的水解反應生產肥皂和甘油
C.乙醇可用作汽車燃料
D.食醋可用于消除暖水瓶中的水垢
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com