
【題目】設NA表示阿伏加德羅常數的值,下列敘述正確的是 ( )
A. 0.3 mol·L-1A1(NO3)3溶液中含A13+數小于0.3 NA
B. H2(g)+I2(g)![]() 2HI(g) △H= - akJ·mol-1,向密閉容器中加入NA個氫分子和NA個碘分子,充分反應后放出的熱量為akJ
2HI(g) △H= - akJ·mol-1,向密閉容器中加入NA個氫分子和NA個碘分子,充分反應后放出的熱量為akJ
C. 常溫常壓下,28 g C2H4、CO的混合氣體中含有碳原子的數目為1.5NA
D. 標準狀況下, Zn│H2SO4(1mol·L-1)│Cu原電池中,正極產生1.12 L H2時,轉移的電子數為0.1NA
【答案】D
【解析】
A. 若為1L、0.3molL-1的AlCl3溶液中,由于Al3+水解,含Al3+的數目小于0.3NA,由于溶液體積未知,無法計算并判斷所含Al3+的數目,故A錯誤;
B. 該反應為可逆反應,NA個氫分子和NA個碘分子,不可能完全反應生成2molHI(g),故放出的熱量比akJ少,故B錯誤;
C. C2H4、CO的摩爾質量都是28g/mol,混合氣體28g,物質的量為1mol,含有碳原子數目與二者的比例關系有關,當二者物質的量為1:1時,含有碳原子的數目為1.5NA,故C錯誤;
D. 用鋅、銅作電極,銅為原電池的正極,電解質為硫酸,正極反應為2H++2e-=H2↑,
n(H2)=![]() =0.05mol,則H+得到0.05mol
=0.05mol,則H+得到0.05mol![]() 2=0.1mol電子,即轉移的電子數為0.1NA,故D正確。
2=0.1mol電子,即轉移的電子數為0.1NA,故D正確。
故選D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】以NA 表示阿伏加德羅常數,下列說法正確的是
A. T℃時,1LpH=6純水中,含10-8NA個OH-
B. 15.6gNa2O2 與過量CO2反應時,轉移的電子數為0.4NA
C. pH=1的H3PO4溶液中含有0.1NA個H+
D. 1molCO和N2混合氣體中含有的質子數是14NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】馬來酸氯苯那敏又名撲爾敏(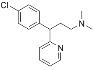 )是一種常見的抗過敏藥物,其合成路線如下:
)是一種常見的抗過敏藥物,其合成路線如下:
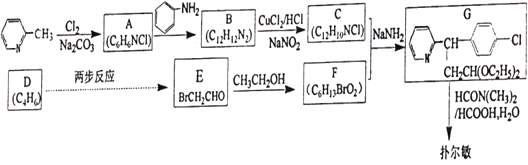
已知:碳碳雙鍵可以被臭氧氧化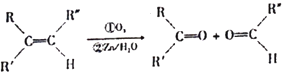
請回答下列問題:
(1)下列說法中不正確的是________。
A.撲爾敏的分子式為C16H18N2Cl
B.G分子中含有兩個手性碳原子
C.化合物C中所有原子可能共平面
D.化合物E能發生取代、加成、氧化、還原反應
(2)化合物B的結構簡式是________。
(3)E![]() F的化學方程式是________。
F的化學方程式是________。
(4)寫出同時符合下列條件的化合物B(C12H12N2)兩個同分異構體的結構簡式________。
①分子中含有兩個六元環;②1H-NMR譜顯示有3個峰。
(5)設計由D經兩步反應得到E的合成路線(用流程圖表示,無機試劑任選)________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按化學反應中元素化合價是否發生變化,無機反應可以分為氧化還原反應和非氧化還原反應。這種分類方法與將無機反應按反應形式的不同分為四種基本反應類型是完全不同的分類方式,這二者的關系如圖。

圖中方框內區域表示所有的化學反應,大圓內區域表示氧化還原反應,大圓外區域表示非氧化還原反應,其中A~D分別表示四種基本反應類型。請分別填出:
(1)化學反應可以分為哪四種基本反應類型:___、___、___、___。
(2)若圖中B圈表示化合反應,則:
B圈與氧化還原反應重疊的陰影部分表示哪一類反應?___________;
C圈與氧化還原反應重疊的陰影部分表示哪一類反應?______________;
請分別舉出符合以上兩種情況的一個例子:________; ___________。
(3)下列說法正確的是___。
A.置換反應一定屬于氧化還原反應
B.有單質參加和有單質生成的化學反應一定是氧化還原反應
C.化學反應中有一種物質被氧化,必定有另外一種物質被還原
D.氧化還原反應發生的本質是化合價發生了變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當今環境污染已成為人類面臨的重大威脅,下列對應關系不完全正確的是
A.酸雨——SO2、NO2、CO2等B.光化學煙霧——NO2、CxHy、CO等
C.溫室效應——CO2、CH4等D.白色污染——各種顏色的難降解的塑料膜、袋等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我們應該從化學的角度認識生活中的問題,下列說法正確的是( )
A.生活污水不是化工廢水,可向江河湖泊里任意排放
B.銨態氮肥與草木灰混合使用可以明顯提高肥效
C.可以用灼燒聞氣味的方法區分滌綸和羊絨
D.通過觀察顏色和聞氣味可以辨別保鮮膜成分是聚乙烯塑料還是聚氯乙烯塑料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】飲用水中的![]() 對人類健康會產生危害,為了降低飲用水中
對人類健康會產生危害,為了降低飲用水中![]() 的濃度,某飲用水研究人員提出,在堿性條件下用鋁粉將
的濃度,某飲用水研究人員提出,在堿性條件下用鋁粉將![]() 還原為N2,其化學方程式為10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
還原為N2,其化學方程式為10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
請回答下列問題:
(1)上述反應中,________元素的化合價升高,則該元素的原子________(填“得到”或“失去”)電子;而________元素的化合價降低,則該元素的原子被________(填“氧化”或“還原”)。
(2)用“雙線橋法”表示反應中電子轉移的方向和數目:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KMnO4在實驗室和工業上均有重要應用,其工業制備的部分工藝如下:
Ⅰ.將軟錳礦(主要成分MnO2)粉碎后,與KOH固體混合,通入空氣充分焙燒,生成暗綠色熔融態物質。
Ⅱ.冷卻,將固體研細,用稀KOH溶液浸取,過濾,得暗綠色溶液。
Ⅲ.向暗綠色溶液中通入CO2,溶液變為紫紅色,同時生成黑色固體。
Ⅳ.過濾,將紫紅色溶液蒸發濃縮,冷卻結晶,過濾,洗滌,干燥,得KMnO4固體。
資料:K2MnO4為暗綠色固體,在強堿性溶液中穩定,在近中性或酸性溶液中易發生歧化反應(Mn的化合價既升高又降低)。
(1)Ⅰ中,粉碎軟錳礦的目的是_____。
(2)Ⅰ中,生成K2MnO4的化學方程式是_____。
(3)Ⅱ中,浸取時用稀KOH溶液的原因是_____。
(4)Ⅲ中,CO2和K2MnO4在溶液中反應的化學方程式是_____。
(5)將K2MnO4溶液采用惰性電極隔膜法電解,也可制得KMnO4.裝置如圖:
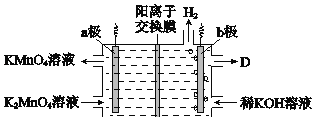
①b極是_____極(填“陽”或“陰”),D是____________。
②結合電極反應式簡述生成KMnO4的原理:___________。
③傳統無膜法電解時,錳元素利用率偏低,與之相比,用陽離子交換膜可以提高錳元素的利用率,其原因是__________。
(6)用滴定法測定某高錳酸鉀產品的純度,步驟如下:
已知:Na2C2O4 +H2SO4 ═H2C2O4 +Na2SO4
5H2C2O4 +2MnO4﹣+6H+═2Mn2++10CO2↑+8H2O
摩爾質量:Na2C2O4 134g/mol KMnO4 158g/mol
ⅰ.稱取ag產品,配成50mL溶液。
ⅱ.稱取bgNa2C2O4,置于錐形瓶中,加蒸餾水使其溶解,再加入過量的硫酸。
ⅲ.將錐形瓶中溶液加熱到75℃~80℃,恒溫,用ⅰ中所配溶液滴定至終點,消耗溶液V mL(雜質不參與反應)。
產品中KMnO4的質量分數的表達式為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com